Композиционное решение это: Что-то пошло не так (404)
«Методы композиционного решения» — искусство, прочее
Мунициальное бюджетное учреждение дополнительного образования
Центр развития творчества детей и юношества
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
«Методы композиционного решения»
Автор-составитель:
Глухова Светлана Александровна,
педагог дополнительного образования
Воронеж, 2019
Методическая разработка
«МЕТОДЫ КОМПОЗИЦИОННОГО РЕШЕНИЯ»
Содержание.
1. Введение
2.Основные теоретические сведения
3. Приемы композиции
4. О восприятии объектов изображения
5. Ритм
6. Сложно-композиционный центр
7. Симметрия
8.Этапы композиционного построения
9. Заключительная часть
Введение
Данное методическое рекомендация ставит перед собой следующую цель: поделиться с коллегами накопленным опытом и личной методикой для качественного усвоения детьми темы «Композиция»
1. Основные теоретические сведения
Основные теоретические сведения
С чего начинается работа над тематической картиной, каковы пути и особенности ее композиционной разработки?
Живописец постоянно наблюдает, эстетически осваивает жизнь, у него накапливается впечатления. Среди многообразных явлений действительности, его особенно волнует, допустим, какое-то общественное явление, которое он пытается осмыслить и рассказать о нем изобразительными средствами. Более целенаправленной становится его наблюдательность, но будущее произведение пока еще представляется в общих чертах. Думая о теме, художник одновременно оценивает ее с определенных идейных позиций. Примерно так образуется идейно-тематическая основа будущего произведения. Затем содержание темы обретает свои более конкретные рамки в сюжете.
Развитие сюжета средствами изобразительного искусства требует композиционных основ (иначе наблюдаемый материал останется нереализованным в художественной форме). В результате складывается замысел художника- более или менее конкретное представление о формальных средствах картины, включая ее конструкцию.
В замысле обычно заложены основы художественного образа, его новизна и потенциальные возможности дальнейшей разработки. Новизна пластического мотива отражает не только новое явление в жизни, но и новые сюжеты. Это новое явление может заинтересовать многих художников и, если они остановятся на одном сюжете, им не избежать однообразия, штампа.
Первоначальные композиционные эскизы должны отвечать таким требованиям, как наличие конструктивной идеи. Конструктивная идея, лежащая в пластическом мотиве, подсказывает место сюжетно-композиционного центра, в котором сосредотачивается плановое в содержании картины.
Наличие конструктивной идеи в первоначальных эскизах помогает установить формат картинной плоскости, масштаб, относительную величину главного и второстепенного, основные тональные и цветовые контрасты.
Поиски композиции продолжаются и в период работы над этюдами, и даже при создании «картона».
Работа над эскизами ведется параллельно с выполнением этюдов, набросков, зарисовок. В процессе создания дополнительного материала уточняется сюжет и это оказывает существенную помощь в период создания картины. Надежным помощниками художника на этой стадии становятся исторические сведения, предметы бытия, документы, военное оружие и снаряжения, памятники архитектуры, зафиксированные при необходимости в этюдах, набросках, зарисовках. Все это предварительная работа, пройдя через контрольный пункт идейно-творческого замысла, позволяет уточнить, усовершенствовать композицию, избавить ее от приблизительности в расстановке смысловых акцентов.
В процессе создания дополнительного материала уточняется сюжет и это оказывает существенную помощь в период создания картины. Надежным помощниками художника на этой стадии становятся исторические сведения, предметы бытия, документы, военное оружие и снаряжения, памятники архитектуры, зафиксированные при необходимости в этюдах, набросках, зарисовках. Все это предварительная работа, пройдя через контрольный пункт идейно-творческого замысла, позволяет уточнить, усовершенствовать композицию, избавить ее от приблизительности в расстановке смысловых акцентов.
Далее наступает время для разработки «картона», то есть рисунка в размер будущей картины. В нем прорисовываются все элементы композиции, включая детали, после чего рисунок с «картона» переносится на холст, бумагу и т. д.
Работая над картиной, живописцу приходится решать целый ряд сложных задач, к примеру, придать локальным цветом (предметной окраске) колористические качества, установить меру интенсивности, насыщенности цветосочетание, словом, лепить светом форму, сверяясь с условиями освещения, образующего светотень и рефлексы. Все эти и другие не менее трудные задачи решаются с прицелом на реализацию идейного содержания, не забывая о силе воздействия законов композиции, на процесс формирования художественного образа средствами живописи.
Все эти и другие не менее трудные задачи решаются с прицелом на реализацию идейного содержания, не забывая о силе воздействия законов композиции, на процесс формирования художественного образа средствами живописи.
В создании композиции большую роль играет подсобные материалы, собранные и проработанные порой недостаточно целенаправленно, теперь на завершающем этапе, вдруг выясняется, что в этом багаже различных сведений не хватает каких-то важных элементов для цельного выражения сути композиции. Выход один: восполнить недостающее, вновь обратившись к источникам, к поискам нужного материала.
Разбитость, дробность, ощущение делимости композиции на несколько самостоятельны= частей мешают зрителю прочитать замысел художника, затрудняют восприятие картины, как целостного организма. Поэтому, заканчивая работу, надлежит обратить внимание на выразительность сюжетно -композиционного центра, его смысловые связи с второстепенными частями картины, сравнить силу контрастов в главном и подчиненном, проверить нет ли повторяемости в тональных напряжениях, формах, величинах.
2. Приемы композиции
Композиционный прием использования горизонтальных направлений дает возможность показать состояние относительного покоя и тишины, например, полотно В.М. Васнецов «После Игорева побоища» построено в горизонтальном формате, что соответствует направление плоскости земли, как поля брани с убитыми войнами.
Использование параллельных, вертикальных направлений подчеркивае состояние парадности, величия, приподнятости.
В пейзаже избегайте схождения линий в центре рисунка.
Помните, что «линии интереса» ведут взгляд наблюдателя вглубь рисунка, а не к боковым его краям.
Старайтесь не размещать основной объект прямо в центре рисунка.
Старайтесь, чтобы линия горизонта не разделяла рисунок на 2-е равные части.
По мере возможности не пилите рисунок на 2-е равные части, контрастирующие друг с другом (белое, черное, насыщенное, ненасыщенное).
Оставьте немного свободного места вокруг объекта.
Избегайте деления картины на 2-е части по принципу строгой симметрии.
Разбавляйте монотонность горизонтальных линий добавлением вертикальных мотивов.
3. О восприятии объектов изображения
Изображенные предметы целесообразно размещать так, чтобы они легко и ясно воспринимались зрителем, даже в том случае, если они частично закрыты другими. Предметы совпадали своими силуэтами или сливались, т. к. одни из них будут воспринимать, как продолжение других, отсюда возникает путаница и становится неясным, каким из соприкасающихся фигур принадлежит рука, нога и т. д. В рисунках Леонардо да Винчи к «Битве при Ангиари» представляющем собой сложную многофигурную. Композицию, в которой изображаются люди и лошади в сильных динамических движениях и ракурсах, фигуры загораживают друг друга и переплетаются между собой.
4. Ритм
Ритм
Ритм в жизни в искусстве, одно из замечательных явлений, он проявляет свои характерные признаки через большую или меньшую периодическую повторяемость какого-либо элемента тождественных, аналогичных положений, дублируемых через некоторые интервалы. Если симметрии свойственно спокойное равновесие элементов, то ритм подразумевает движение, которое может быть продлено до бесконечности.
Ритм- это не только организующее начало. В композиции, но эстетическое именно через него сообщаются произведению поэтические, музыкальные свойства, неотделимые от художественности. Ритм выполняет организующую и эстетическую роль в композиции. Его действенность основывается на законах композиции, на тональных и цветовых контрастах. Именно наличие тональных или цветовых контрастов обеспечивает восприятие изображенного изделия, даже на далеком расстоянии при угасании тональных и цветовых контрастов ритм почти не воспринимается, даже при наличии контрастов величия или положений предметов в пространстве (дальше — ближе). Вот почему очень важно определить основные контрасты уже в эскизах композиции. Только придерживаясь этого положения, можно рассчитывать на активное действие ритма и помощь его в закономерной организации произведения.
Вот почему очень важно определить основные контрасты уже в эскизах композиции. Только придерживаясь этого положения, можно рассчитывать на активное действие ритма и помощь его в закономерной организации произведения.
Чередование элементов в композиции побуждает зрителя думать, воспринимать сюжет в его развитии. Это свойство ритм определяет его связь с композиционным законом типизации, который требует художника проникать в движении внутреннее и не ограничиваться показом движения внешнего.
Ритм был и есть во всех видах искусства и во все времена. И в странах древнего востока композиция была упорядочена, отличалась строгостью, наличием ритма, в древнеегипетском искусстве фриз являлся основной формой композиции, в которой ритмически чередовались изобразительные элементы.
5. Сюжетно-композиционный центр
Центром композиции является та часть, которая достаточно ясно выражает главное в идейном содержании и сюжет. Центр выделяется объемом, освещенностью и другими средствами, действующими в соответствии с основными законами композиции. Композиционный центр должен в первую очередь привлекает внимание зрителя. Конечно, в сюжете, в пластическом мотиве не все одинаково важно, и второстепенные части, детали должны быть строго взаимосвязаны, подчинены главному, образуя вместе с ним единое целое- произведение искусства.
Центр выделяется объемом, освещенностью и другими средствами, действующими в соответствии с основными законами композиции. Композиционный центр должен в первую очередь привлекает внимание зрителя. Конечно, в сюжете, в пластическом мотиве не все одинаково важно, и второстепенные части, детали должны быть строго взаимосвязаны, подчинены главному, образуя вместе с ним единое целое- произведение искусства.
Центр композиции включает сюжетную связку с главными действующими лицами и аксессуарами. Построение всего произведения со всеми его частями ведется во имя выявления идейного содержания с опорой на действие закона цельности. Выделение главного в композиции связанно с особенностью зрительного восприятия человека, фиксирующего своё внимание, прежде всего, на сильно действующем раздражителе, это могут быть движение, световые эффекты или резкое изменение условий освещенности, контрастов, тоновые и цветовые, контрасты величин, форма и т. д. Так зрительно воспринимает предметный мир любой человек, в том числе и художник.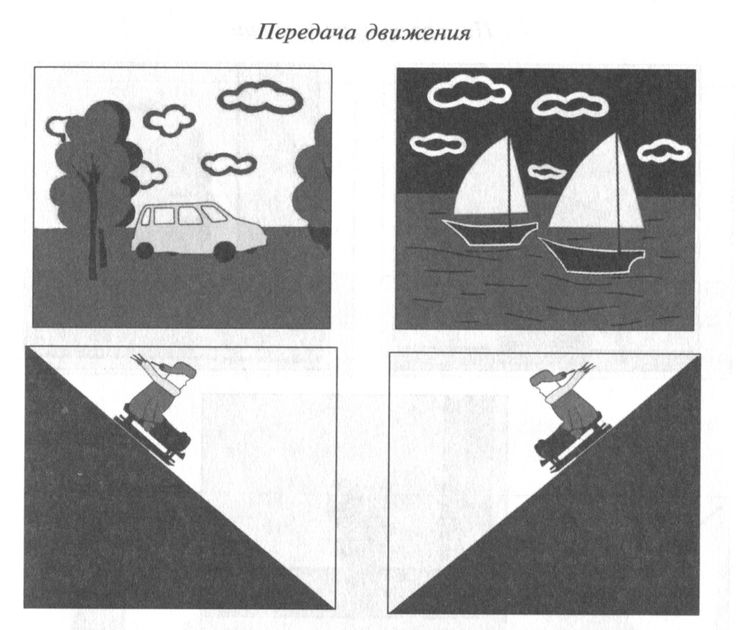 Отсюда исходит характер чувственно-образного мышления художника, обязанного учитывать особенность восприятия картины зрителем.
Отсюда исходит характер чувственно-образного мышления художника, обязанного учитывать особенность восприятия картины зрителем.
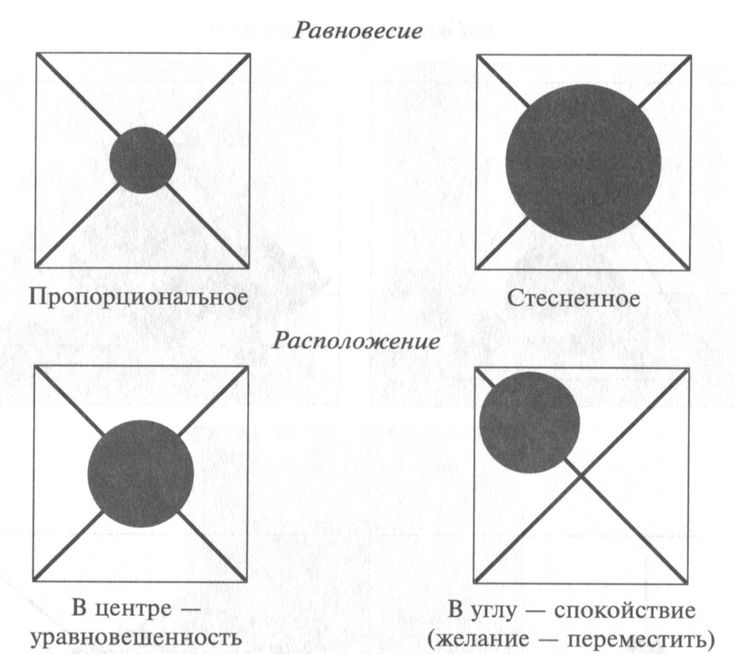
В композиции очень редко идейная завязка берется в буквальном геометрическом центре. Такое геометрическое равновесие по центру идет в разрез с впечатлением, даваемыми непосредственным восприятием жизни. Центр композиции может немного переместиться в сторону, но вместе, чтобы отдать остальное пространство холста ненужному материалу или пустоту, ничем не оправданному пространству. Здесь нужно иметь в виду законы равновесия, ощущение заполненности холста (формата работы) композицией. Наиболее ценной является та композиция, от которой нельзя ничего отнять и к которым нельзя ничего прибавить. Важное значение для выявления смыслового центра имеет соотношение размера предметов, входящих в произведения, неудачной окажется та композиция, в которой объекты центра будут или слишком маленькими, или наоборот, слишком большими по отношению к остальным частям и к размеру картинной плоскости.
6. Симметрия
Симметрия в искусстве вообще и в изобразительном, в частности, берет свое начало в сфере реальной действительности. Одинаковость левой и правой половины дает понятие равновесия, что наблюдается и в природе, и в различных видах искусства. Для симметричной организации композиции характерна уравновешенность ее частей по массе , по тону, цвету и даже по форме. В таких случаях одна часть почти всегда имеет ярко выраженный центр. Как привило, он совпадает с геометрическим центром, картинной плоскости. Если точка схода смещена от центра, одна из частей более загружена по массам или изображение строится по диагонали, все это сообщает динамичность композиции и в какой-то мере нарушает идеальное равновесие.
Устойчивые композиции вызывают у зрителя впечатление уверенности, боевой тотальности богатырей- защитников земли русской. Мало того , в «богатырях» передано состояние напряженного покоя на грани перехода в действие. А это знания, что и симметрия таит в себе зародыш динамического движения во времени и пространстве.
А это знания, что и симметрия таит в себе зародыш динамического движения во времени и пространстве.
7. Этапы композиционного построения
Давайте выполним упражнение, которое впоследствии помогут нам выполнить любую композицию.
1. Выбор темы композиции «Праздник»
2. Теперь нужно задать себе вопросы.
-Какие праздники мы знаем?
-Какие ассоциации вызывают (День рождения, Масленица, Рождество, День Нептуна и д.р.)
Наверняка, у каждого из вас возникли идеи и вы уже выбрали , какой из праздников вы будете изображать. Но нельзя забывать о том, что грамотную композицию невозможно решить без знания элементарных основ композиции.
3. Мы решили изобразить старинное гуляние. Выполните несколько набросков, а затем закомпонуйте в листе, так чтобы это было ритмически правильно.
4. Далее нужно продумать фон, на котором будут изображены наши персонажи. Фон в виде старого, деревянного дома, подойдет к нашей композиции. Для этого нужно сделать наброски старых домов, и отдельных элементов дома, которые могут нам пригодиться в работе.
Фон в виде старого, деревянного дома, подойдет к нашей композиции. Для этого нужно сделать наброски старых домов, и отдельных элементов дома, которые могут нам пригодиться в работе.
5. Следующим нашим шагом будет выбор времени года, суток, состояния природы. Следует воспользоваться этюдами.
6. Последним нашим шагом будет соединение всего материала в единую композицию.
8. Заключительная часть
Данная методическая рекомендация является актуальной, т. к. педагог используя свой накопленный опыт работы с детьми предлагает наиболее рациональный вариант работы над композицией, его этапами. Также акцентируется внимание на тщательности в подборе сюжетно-композиционного центр, фона и предварительной проработке вариантов эскизов.
Список используемой литературы
1. Костерин Н.П. Учебное рисование. М. Просвещение, 1994.
2. Компанцева Л. В. Поэтический образ природы в детском рисунке. М. Просвещение. 1995.
В. Поэтический образ природы в детском рисунке. М. Просвещение. 1995.
3. Художественная энциклопедия: Архитектура. Живопись. Скульптура. Графика. Декоративное искусство. Гл. Ред. В.М. Полевой. М. Сов. Энциклопедия , 1996 г.
4 . Волков И.П. Учим творчеству. М.1992.
7
Композиционное решение кадра
Кино, утверждающее себя как искусство, вырабатывало свой язык, прежде всего, в плане изобразительном. Ведь до того кино было простой репродукцией, съемкой натуры (хроника и «видовые») или специально разыгрываемого театрального спектакля (ранние игровые фильмы). Сделать кино искусством означало в те годы, прежде всего, превратить объектив из пассивного в активный. Аппарат удаляется или приближается к актеру, останавливается на мизансцене, входит внутрь нее, смотрит вниз. Так рождается план и ракурс. Меняется и варьируется оптика, затем выступает проблема освещения — рождается тональность и оптическая трактовка изображения в кадре. На следующем этапе развития кинематографии главными проблемами стали отбор изображаемых объектов и их размещение на изобразительной поверхности, вопрос о так называемой «экономии изображения», об «уплотнении изображения». Изображать только необходимое и в наиболее идейно и зрительно эффектном виде стало справедливым лозунгом дня.
На следующем этапе развития кинематографии главными проблемами стали отбор изображаемых объектов и их размещение на изобразительной поверхности, вопрос о так называемой «экономии изображения», об «уплотнении изображения». Изображать только необходимое и в наиболее идейно и зрительно эффектном виде стало справедливым лозунгом дня.
Отбор изображения отчасти достигался кадрированием (работой с рамкой визира) и ракурсами, о чем речь уже была выше, а отчасти выбором и размещением декораций и актеров перед аппаратом. В этом последнем случае кинорежиссер естественно пользовался опытами того же театра, в котором, начиная с Г. Крега и кончая В. Мейерхольдом, шла длительная полоса опрощения фона, уменьшения количества деталей, стремление к предельной лаконизации декорации и всего построения мизансцены.
Поначалу кинематографисты лишь выводили из внимания зрителя края кадра, затемняя их, но не организовывали плоскости кадра. Дальнейший рост композиционного умения основывался на том, что стандартность и неизменность форм экранного изображения заставляет зрителя все равно всегда видеть экран целиком, что компоновать надо обязательно в пределах всей поверхности этого четырехугольника.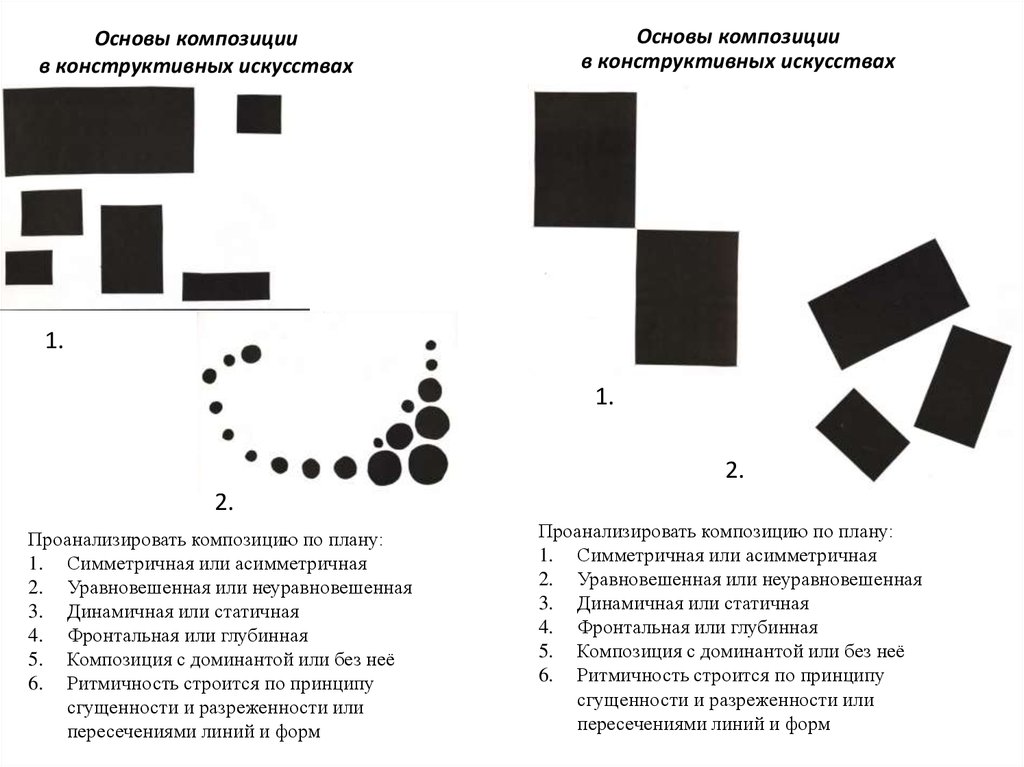 Это в особенности важно тогда, когда композиция носит по преимуществу объемно-линейный характер. Из двух основных композиционных моментов — бесцветная кино-линейно-объемная форма и светотень (тональность) — Пудовкин и Головня интересуются по преимуществу первым. Их композиции суть прежде всего композиции объемов, линейный рисунок и выбор рамки кадра, то есть опять-таки то же расположение объемов. Светотень, пятна света и тени, как и оптика, имеют подчиненное значение. Это не значит, что Пудовкин и Головня не интересовались светом и оптикой. Они играют у них серьезную роль в трактовке и характеристике изображения ‹…›.
Это в особенности важно тогда, когда композиция носит по преимуществу объемно-линейный характер. Из двух основных композиционных моментов — бесцветная кино-линейно-объемная форма и светотень (тональность) — Пудовкин и Головня интересуются по преимуществу первым. Их композиции суть прежде всего композиции объемов, линейный рисунок и выбор рамки кадра, то есть опять-таки то же расположение объемов. Светотень, пятна света и тени, как и оптика, имеют подчиненное значение. Это не значит, что Пудовкин и Головня не интересовались светом и оптикой. Они играют у них серьезную роль в трактовке и характеристике изображения ‹…›.
Но, так или иначе, освещая объем, давая блики и глубокие тени, применяя рассеянный свет и так далее, они компонуют, исходя все же из линейно-объемных принципов композиции, а не из принципов свето-воздушной, то есть тональной композиции.
В этом отношении связь Пудовкина с театром обнаруживается уже в гладких фонах, в вещественном лаконизме мизансцен «Шахматной горячки». То, что было сделано в этом направлении далее кинематографом, сводилось к предельному сужению пространства «сцены» до необходимого для движения актера или группы актеров пространственного минимума.
То, что было сделано в этом направлении далее кинематографом, сводилось к предельному сужению пространства «сцены» до необходимого для движения актера или группы актеров пространственного минимума.
Декорация «углом», помещение в кадре только той части павильона, в которой в данное время происходит действие, а также «диафрагмирование» светом было затем перенесено и в театр (архитектурные сооружения со многими площадками, на каждой из которых разыгрывается один из эпизодов акта, причем сценическая коробка погружена в темноту и освещается лишь данная площадка; иногда выделение эпизода и сужение пространства достигалось только одним прожекторным освещением).
«Уплотнение кадра» Пудовкин и Головня ставили как вполне сознательную задачу: «В построении кадра мы следили за тем, чтобы происходило действенное и максимальное его заполнение. В кадре часто бывают по краям мертвые крылья, мы следим за тем, чтобы в кадре не было лишнего ненужного места» (1926).
Первым приемом такого устранения «мертвых крыльев» была растушевка, которую видим часто применяемой в «Матери». Но растушевка, как отчасти и выделение направленным светом, было пассивным способом уплотнения кадра. В противоположность, например, композиции пятен у Москвина, композиции Головни суть композиции объемно-линейного рисунка, исключение представляют разве лишь кадры речного порта в «Дезертире».
Но растушевка, как отчасти и выделение направленным светом, было пассивным способом уплотнения кадра. В противоположность, например, композиции пятен у Москвина, композиции Головни суть композиции объемно-линейного рисунка, исключение представляют разве лишь кадры речного порта в «Дезертире».
Работа Кабалова с Пудовкиным в «Простом случае», отличаясь некоторыми моментами от работы Головни (фотография более воздушна, тональная гамма светлее и короче, но зато более градуирована), носит в основном тот же характер.
Как образцы хорошей работы с эффектами бликов света можно отметить ночной кадр прохода Власова у забора, Павла в тюремной камере («Мать»), внутренности юрты с игрой сетки теней и бликов света («Потомок Чингисхана»), кадры Петропавловской крепости, ворота Зимнего, пулеметчиков на набережной («Конец Санкт-Петербурга»).
Это различие манер, а не стилей, «почерков», а не принципов. Это заставляет и нас сосредоточить свое внимание на проблеме объема, его трактовке, композиционной связи объемов между собой, связи с пространством и размещении в рамке кадра.
Композиция кинокадра отличается от композиции статической фотографии тем, что изображение в ней движется, то есть перемещается, изменяет свою форму. Это вносит существенно новые моменты, которые должны учитывать и организовывать режиссер и, в первую очередь, оператор. Можно строить композицию кадра с установкой на эффект именно движения, то есть таким образом, что композиция есть некоторый след движения формы, развертывающийся во времени и пространстве, «рисунок» его изменения. Но, наряду с таким динамическим решением композиции, может быть и решение статическое. Если в первом исходная и конечная точки движения не совпадают и имеют подчиненное значение, то во втором они зачастую фактически совпадают и во всяком случае являются определяющими. Движение формы или группы форм берется, таким образом, в замкнутые рамки, имеет все время ту же композиционную форму и носит своего рода кругообразный характер. Оно постоянно возвращается в исходное положение движущейся формы, даже при наличии очень бурного движения, сохраняет более или менее неизменным свое положение по отношению друг к другу, свое размещение в данном кадрируемом пространстве. Между этими двумя противоположными формами решения композиции движущегося изображения можно расположить все остальные. В фильмах Пудовкина находим оба эти типа композиции. Типичными примерами первого могут служить кадры проходов и проездов, например, вынос умирающего командира на носилках в «Потомке Чингисхана». Примерами второго, для однофигурного изображения — умывание мальчика в «Простом случае», для массовок — упоминавшиеся уже сцены встреч бастующих со штрейкбрехерами («Дезертир»). Однако предпочтение отдается статической форме композиции, в особенности в позднейших фильмах. Это вытекает из статичности однозначного кадра монтажной системы и из господствующего положения в ней крупного плана. В «монтажном кино» разворот объекта в движении осуществляется также в монтаже, как сопоставление разных точек и планов, и, таким образом, каждый из монтируемых кадров строится как статическая композиция, а динамическая композиция осуществляется в «рисунке» всего куска сцены. В кадрах с движением прохода или проезда при неподвижном аппарате изменяемость композиции от перемещения форм ослабляется тем, что движение имеет обычно одно и прямолинейное направление.
Между этими двумя противоположными формами решения композиции движущегося изображения можно расположить все остальные. В фильмах Пудовкина находим оба эти типа композиции. Типичными примерами первого могут служить кадры проходов и проездов, например, вынос умирающего командира на носилках в «Потомке Чингисхана». Примерами второго, для однофигурного изображения — умывание мальчика в «Простом случае», для массовок — упоминавшиеся уже сцены встреч бастующих со штрейкбрехерами («Дезертир»). Однако предпочтение отдается статической форме композиции, в особенности в позднейших фильмах. Это вытекает из статичности однозначного кадра монтажной системы и из господствующего положения в ней крупного плана. В «монтажном кино» разворот объекта в движении осуществляется также в монтаже, как сопоставление разных точек и планов, и, таким образом, каждый из монтируемых кадров строится как статическая композиция, а динамическая композиция осуществляется в «рисунке» всего куска сцены. В кадрах с движением прохода или проезда при неподвижном аппарате изменяемость композиции от перемещения форм ослабляется тем, что движение имеет обычно одно и прямолинейное направление. Движение чаще всего развивается параллельно плоскости экрана (проезды в «Потомке Чингисхана»). В кадр зачастую вводится какой-либо пейзажный элемент (дерево, камень, скала, дом и так далее), который на общем плане, оставаясь статичным, способствует известной неизменяемости композиции.
Движение чаще всего развивается параллельно плоскости экрана (проезды в «Потомке Чингисхана»). В кадр зачастую вводится какой-либо пейзажный элемент (дерево, камень, скала, дом и так далее), который на общем плане, оставаясь статичным, способствует известной неизменяемости композиции.
Относительное сохранение исходной конфигурации обнаруживается и при проходах из глубины кадра на аппарат (ищущая мужа женщина в «Конце Санкт-Петербурга») или, наоборот, в глубь кадра (проход человека в прологе «Простого случая»).
В композиционном решении задачи «уплотнения кадра» основными средствами Пудовкина-Головни являются ракурс и крупный план. Выше уже отмечалась роль ракурса в «изоляции» человека или предмета.
В этой изоляции он часто наполняет собой кадр, в особенности на средних и крупных планах. Очень часто в «Матери» и в дальнейших фильмах (особенно в обыгрывании архитектуры города в «Конце Санкт-Петербурга» и в планах бойцов в эпизоде боя в «Простом случае») ракурсная подача изображения преследует не столько идейно характеризующие, сколько чисто композиционные цели. Крупный план уже сам по себе является выбором объекта, заполняя весь кадр одним предметом или лицом, он приводит к срезам их частей. Кадр является, таким образом, предельно заполненным и совершенно лишенным всяких пустот. Очень часто ракурс является средством размещения формы, подчеркивающим характер изобразительной поверхности, ей подчиненным. Ракурс располагает линии и контуры предмета вдоль длинных сторон кадра или вертикально: параллельно коротким или параллельно одной короткой и одной длинной.
Крупный план уже сам по себе является выбором объекта, заполняя весь кадр одним предметом или лицом, он приводит к срезам их частей. Кадр является, таким образом, предельно заполненным и совершенно лишенным всяких пустот. Очень часто ракурс является средством размещения формы, подчеркивающим характер изобразительной поверхности, ей подчиненным. Ракурс располагает линии и контуры предмета вдоль длинных сторон кадра или вертикально: параллельно коротким или параллельно одной короткой и одной длинной.
Весьма распространенным приемом ракурсного размещения изображения в четырехугольнике кадра является диагональ или две противоположные диагонали. Диагональная композиция, «косой кадр» были излюбленнейшим приемом «динамизирования» статичного изображения в «левой» фотографии и кино примерно 1922–1930 годов. ‹…›
Ракурс оказывается тем реалистичнее, чем более его характеризующая роль совпадает с его композиционной ролью.
Это же относится и к срезам, а также верхним и нижним точкам зрения, посредством которых Пудовкин передает ощущение давящейся тяжести, гнета или, наоборот, радости, торжества, свободы. Там, где Пудовкин уничтожает пространство ракурсом, чтобы передать придавленность человека к земле, униженность (мать на полу), или дает много пространства, воздуха ради той или иной сюжетно-идейной задачи (например, в кадрах наступления врага в эпизоде боя или выхода из-за горизонта на аппарат, как из-под земли появление носилок с раненым командиром партизан в «Потомке Чингисхана», выход ищущей мужа женщины на Горбатый мостик в «Конце Санкт-Петербурга»), — он работает как реалист. И, наоборот, срезы крупных планов голов биржевиков в «Конце Санкт-Петербурга», бойцов в «Простом случае» и вообще большинство ракурсов этого фильма формалистичны по своей самодовлеемости. Этим и обусловливается в смысле ракурса и других моментов то, что гораздо более «левая» по своим внешним приемам изобразительная сторона «Матери» в принципе гораздо реалистичнее «Простого случая» и «Дезертира».
Там, где Пудовкин уничтожает пространство ракурсом, чтобы передать придавленность человека к земле, униженность (мать на полу), или дает много пространства, воздуха ради той или иной сюжетно-идейной задачи (например, в кадрах наступления врага в эпизоде боя или выхода из-за горизонта на аппарат, как из-под земли появление носилок с раненым командиром партизан в «Потомке Чингисхана», выход ищущей мужа женщины на Горбатый мостик в «Конце Санкт-Петербурга»), — он работает как реалист. И, наоборот, срезы крупных планов голов биржевиков в «Конце Санкт-Петербурга», бойцов в «Простом случае» и вообще большинство ракурсов этого фильма формалистичны по своей самодовлеемости. Этим и обусловливается в смысле ракурса и других моментов то, что гораздо более «левая» по своим внешним приемам изобразительная сторона «Матери» в принципе гораздо реалистичнее «Простого случая» и «Дезертира».
Верхняя точка зрения, употребляемая в изображении массовых сцен с большим или меньшим движением, является у Пудовкина чаще всего статическим принципом решения композиций движения. Марширующие во дворе завода солдаты («Мать») как будто на плоскости картины вычерчивают орнаментальный рисунок. Танцы лам («Потомок Чингисхана») — пример кругового построения композиции движения, уложенного в жесткие рамки неизменности основной схемы пространственного размещения фигур. В кадрах встреч бастующих со штрейкбрехерами («Конец Санкт-Петербурга» и «Дезертир») бастующие расположены стеной наверху, а штрейкбрехеры также стеной внизу вдоль длинных сторон кадра. Посредине открытое пространство — арена действия. Это образец блестящего решения задачи ясности и четкости композиционного построения массовки, где сложное движение вмещено в неизменные рамки неизменяемой композиции.
Марширующие во дворе завода солдаты («Мать») как будто на плоскости картины вычерчивают орнаментальный рисунок. Танцы лам («Потомок Чингисхана») — пример кругового построения композиции движения, уложенного в жесткие рамки неизменности основной схемы пространственного размещения фигур. В кадрах встреч бастующих со штрейкбрехерами («Конец Санкт-Петербурга» и «Дезертир») бастующие расположены стеной наверху, а штрейкбрехеры также стеной внизу вдоль длинных сторон кадра. Посредине открытое пространство — арена действия. Это образец блестящего решения задачи ясности и четкости композиционного построения массовки, где сложное движение вмещено в неизменные рамки неизменяемой композиции.
Федоров-Давыдов А. Изобразительная культура фильмов В. И. Пудовкина. М.: [Б. и.], 1972.
Композиционные решения в изобразительном искусстве и кинематографе
Скорик Елена Александровна,ГБОУ ЦО № 109, Москваskorikcrew@yandex. ru
ru
Скорик Александр Александрович,телевидение, руководитель отдела «Постпродакшн», Москва skorikcrew@yandex. ru
Композиционные решения в изобразительном искусстве и кинематографе
Аннотация.В статье рассматривается влияние изобразительного искусства на композиционную выразительность киноязыка и его образность. Определяются общие корни, лежащие в основе кинематографического и изобразительного мастерства. Особое внимание обращается на аналогию художественных приёмов в живописи с приёмами в кинематографической сфере, таких как цветовое решение композиций произведений, сопоставление пространственных планов, трансформация изобразительных ракурсов и перспектив в вариативность экранной визуальности. Материал предназначен для искусствоведов, культурологов, художников, специалистов кино и всех читателей, которые интересуются историей изобразительного искусства и его взаимоотношением с кинематографом. Ключевые слова:киноязык, кинематографическое пространство, колористическое оформление фильма, ракурс, перспектива.
Художественный мир фильма кроме отражения авторского видения сложным образом связан с манерой его визуальной репрезентации, выражаемой в особом феномене киноязыка. Все,что мы называем элементами киноязыка,сводится к тому,чтобы дать в руки создателя фильма выразительные средства,насыщающие произведениесмыслом и способствующие слияниюинтенции автора, его творческого воображения,с переживаниями зрителя. «Кинематограф вызревал в недрах всей культуры прошлого. Кино заимствует сложившиеся в иных сферах культуры структуры и осваивает их, а сама культура медленно движется к кино» [Ямпольский М. Тиресия. Интертекстуальность и кинематограф. М., 1993. С.156], но особенно актуально это для её изобразительной составляющей. Целесообразно рассмотреть и сравнитьобразность кино инаполнениеегокадровс художественной образностьюпроизведенийвеликих мастеров живописи.
Живопись дала кинематографу композиционноепостроение кадра и организацию цветового решения. Композиционное целое в картине замкнуто в формате холста, а в кинематографе –в кадре. Построение художественного полотна–одна из главных задачв организациипроизведения. В содержанииживописных образовавтор достигает во многом невозможного благодарянахождениюнужного композиционного решения. Важную роль в системе художественных средств композиции играет цвет.
Композиционное целое в картине замкнуто в формате холста, а в кинематографе –в кадре. Построение художественного полотна–одна из главных задачв организациипроизведения. В содержанииживописных образовавтор достигает во многом невозможного благодарянахождениюнужного композиционного решения. Важную роль в системе художественных средств композиции играет цвет.
Выделение центра картины определённым цветовым пятном –популярный приём в творчестве художников, и он, как правило, несёт в себе особую смысловую нагрузку. Цвет воздействует на психологическое состояние человека, помогает сформировать определённый образ,вызвать конкретные эмоции и ассоциации. Красное пятно –классика в живописи. Алый плащ Гекторахарактеризует воинскую доблестьв картине А. Лосенко «Прощание Гектора с Андромахой» (1773г.). Юноша в красной рубахе с высоко поднятой головой –олицетворениегрядущих перемен («Бурлаки на Волге» 1870–1873гг.). Пламенеющий конь в сюжете К. ПетроваВодкина «Купание красного коня» (1912г.) ассоциируется с революционным обновлением мира.
Подобный подходк цветовому решениюкадра, являющегося миникинокартиной,используетсяхудожникамипостановщикамисинтетического экранного искусства.Красный шарф героини фильма«Мама миа»(реж. Ф.Ллойд, 2008г.) притягивает к ней внимание, помогает увидеть её вдалеке на горной тропинке. МалиновыйнарядТатьяны Лариной выделяет её в бальном вихрекружащихся пар («Онегин»,реж. М.Файнс, 1999г.). Алыйгалстукглавного героя в чёрнобелой ленте «Мститель» (реж. Ф. Миллер, 2008г.) усиливает драматизм сюжета,какинапряжённый красный цветфлагав фильмеС. Эйзенштейна «Броненосец Потёмкин»(1925г.).
Белый и чёрный цвет –связующие звенья. Контрастноесочетание чёрного пятна одежды боярыни на белом снегу придаёт тревожный колорит картине В. Сурикова «Боярыня Морозова» (1887г.). Подобный эффект создаётся в эпизодах фильма «Война и мир» (реж. С. Бондарчук, 1965–1967гг.) –чёрное платье Элен среди белыхнарядов присутствующих на балу дамсоответствует её характеру, её тёмной сущности.
С. Бондарчук, 1965–1967гг.) –чёрное платье Элен среди белыхнарядов присутствующих на балу дамсоответствует её характеру, её тёмной сущности.
Голубой и синий цвета обычно не используются на первом планедля формирования центра композиции. Воздушная перспектива предполагает холодный колорит для дальних ландшафтов. Но лучшие русские живописцы, великолепно зная классические правила, нарушают их. В своихдвухцветных гризайляхФ. Васильевпомещал холодные серые на ближний, а тёплые коричневые оттенки –на дальний план. Получался удивительный эффект свечения неба. Английский живописец Т. Гейнсборо в картине «Мальчик в голубом»(1770г.) доказал, что акцент может быть в любом колоритев зависимости от его проработки и окружающего пространства. Фон был написан тёплыми тёмнокоричневыми пигментами, а аристократическийнаряд юноши на первом плане –холодными синеголубыми. Цветовое решение фильмов«Шаг вперёд» (реж. Э. Флетчер, 2006г.) и «Дневники няни» (реж. Ш. С. Берман, Р Пульчини, 2007г.). соотносится сработойГейнсбороиспользованиемсинего цветаодежды главных героевв качестве выделяющего его среди молодёжи вкостюмахчёрносерой гаммы.
Таким образом,эмоциональная действенность цвета формирует образ, способствует его становлению и определению в композиционном пространстве. Цветовые темы в живописи корреспондируются в кинематограф и вызывают определённые психофизиологические реакции зрителя.
Варьирование на экране цветныхи чёрнобелых кадров направлено на дифференциациюразрозненных событийфильма: прошлого и настоящего, настоящего ибудущего, грёз ияви,мистики и реальности. Цветные кадры перебиваются монохромными,отделяя вымысел от реальности, повседневность жизни от версификации воспоминаний. Решения могут быть многовариантными. Цветсменяетсяна чёрнобелый тони наоборот,илиреализованноев сюжетеполихромно настоящее ипрошлое,действительностьи вымыселразграниченыкороткими монохромнымикадрамиперебивками(«Коко Шанель»,реж. К. Дюге, 2008г.;«Княжна из хрущёвки»,реж. Т. Кабулов,2013г.). Бывает, что в последовательноеразвёртываниекиноистории, выполненной в цветовой палитре,включаютсячёрнобелыестопкадры,якобы запечатлённыефотоаппаратомиразделяющиереалистическийслой от фотографического уровня(«Неверная»,реж.
 Поэтому вданном сюжете, построенном наигре со временем,реалии и воспоминания в динамической сменесливаются. Таким образом,колористическоеоформлениефильма влияет на его выразительность,реализует иконкретизируетего композицию,является, несомненно, творческим процессом.
Поэтому вданном сюжете, построенном наигре со временем,реалии и воспоминания в динамической сменесливаются. Таким образом,колористическоеоформлениефильма влияет на его выразительность,реализует иконкретизируетего композицию,является, несомненно, творческим процессом.В мире изобразительного искусства традиции монохромной живописи с полихромными включениямизародились в Древнем Китае, развивались в Японии, с успехом перенималисьевропейскими художниками и, передаваясь из поколения в поколение,транслировались в синематическое творчество. И вот уже современная живописьзаимствует цветовыекинематографические приёмы для темы памяти, сочетанияпрошлого и настоящего. Выставка заслуженного художника России Т.Назаренко«Фамильный альбом. Ретроспектива» (2011г.) представляла произведения, обращённыек старому фамильному архиву. На каждом полотне преодоление временных границ, разделяющих истории прошлого, происходит за счёт двухвариантного цветового решенияинтеграциифотографий из семейного альбома автора.
Богатством сопоставленияразличных пространственных планов композициинаделено творчество многих великих мастеров. Вглубинныхмизансценахнамеренно в центре композиции увеличивается реальный размер тел,но уменьшаетсяк краям и в уходящемвдаль пространстве(Микеланджело «Мадонна Дони»,1507г.). Выделение значимых фигурсюжета увеличениемих формата было особенностьюдревнеегипетского искусства(«Охота в нильских зарослях» –роспись из гробницы в Фивах, XV–XIVвв. до н. э.). Эта традиция характерна и для древнегреческой, византийской, древнерусской культур. В эпоху Ренессансав портретнойживописи, выстроенной на основеглубокой перспективы, крупный первый план силуэтом выделялся на фоне далёких пейзажей (Пьеро делла Франческа «Федериго де Монтефельтро, герцог Урбинский»,1465г.). В кинематографе для придания значимости главному героютакже одним из способоворганизации глубинной мизансцены в кадре является совмещение крупногоизображения первого плана и сильно удалённого второго («Иван Грозный»,реж.

Точки зрения на натуру, а также положения натуры в пространственазываются ракурсами. Выбор ракурсапроизводится с целью наиболее полной и эффектной передачи образа, зависит от оценки предмета и его эмоциональной окраски. Артклассификация углов обзора корреспондируется с синематической. Обзором с низкого горизонта живописцы пользовались в композициях монологического характера для выделения героя над окружением. Художнику А. Ватто в картине «Жилль»(1717–1719гг.) удивительно удалось меланхолическое одиночество Пьеро, возвышающегося над пленэрным антуражем. Художники кинематографа достигают значительного размаха в границах кадра также благодаря применению низкой точки зрения. В фильме“MidWay”(реж. J. Smight, 1976г.) ракурс снизу увеличивает мощь авиатехники. Иные стилистические возможности присущи высокому горизонту. Верхний ракурс, выбранный мастером,открывает панорамный виднеобъятных просторов(П. Брейгельстарший «Охотники на снегу», 1565г.). Особым достижением стала аэроживопись –изобретение футуризма, предлагающеезрителю необычно высокую зрительную позицию (Т. Крали «Пике над городом»). Благодатной почвой для её возникновения стал всеобщий интерес в обществе к начавшемуся в начале 20х гг.ХХ столетия массовому использованию авиации. В кинематографе высокаяпроекциянеобходимадля широкого угла обзора –обозрения панорамыиз самолёта, из окна небоскрёба, с вершины горы(«Изгой»,реж. Р. Земекис, 2000г.;«2012»,реж. Р. Эммерих, 2009г.).
Крали «Пике над городом»). Благодатной почвой для её возникновения стал всеобщий интерес в обществе к начавшемуся в начале 20х гг.ХХ столетия массовому использованию авиации. В кинематографе высокаяпроекциянеобходимадля широкого угла обзора –обозрения панорамыиз самолёта, из окна небоскрёба, с вершины горы(«Изгой»,реж. Р. Земекис, 2000г.;«2012»,реж. Р. Эммерих, 2009г.).
Умение найти эффектный ракурс определяет мастерство режиссёра, художникапостановщика и оператора. Творческий поиск приводит кинтересным находкам. Необычно выглядит материал, снятыйв перевёрнутом ракурсе(«12 друзей Оушена»,реж. С. Содерберг,2004г.; «Области тьмы»,реж. Н. Бёргер,2011г.). Всинематическомисполнении он корреспондируется с подобной ориентацией в экспериментальных живописных произведенияхперевёртышахД. Арчимбольдо(«Садовник» 1590г.),замаскировавшеговторые изображенияв перевёрнутом виде. Перевёрнутые илиопрокинутыефигурывтворчестве Тинторетто и Караваджопридавалистремительный динамизмихизощрённымкомпозициям(Я. Тинторетто «Чудо святого Марка»,1548г.).
Тинторетто «Чудо святого Марка»,1548г.).
Композиции могут быть нарисованы на холсте или сняты в кино с разных точек зрения.Многоракурсовое построениев китайской живописи давалохудожнику полный просторвоображению, не связывая его рамками ограниченного горизонтом пространства. Леонардо да Винчи также в одном художественном формате рисовал растения, животных и людей во всевозможных планах («Эскиз головы Леды»,1508г.). Композиционныеточки зрения в изобразительном тексте стали вариативностью для экранной визуальности.
Ещё одно художественное средство, усиливающее выразительность образов,–это перспектива. Зарождение линейной перспективы относят к XIV в. Первопроходцем в данном направлении, воплотившем на плоскости иллюзию трёхмерного пространства, считают Джотто ди Бондоне («Благая весть святой Анне», 1304–1306гг.). До линейной перспективы существовала обратная перспектива –явление, характерное дляискусства Древнего Востока, европейского Средневековья и христианской иконописи. Реалистическая живопись изображает предметный мир по законам линейной перспективы, при этом все горизонтальныелинии мысленно сходятся в одной точке, находящейся за плоскостью изображения, создавая иллюзию глубины. Точка пересечения линийпри обратной перспективенаходится перед картиной, там, где стоит зритель. В двадцатом столетии, начиная с П.Сезанна, развитие живописивновь знаменует возврат к обратной перспективе. Принципы обратной перспективы могут рассматриваться и как зеркальность прямой перспективы, которые были применены режиссёром А. Медведкиным вкинодраме «Счастье» (1934г.). Пространство фильмакак бы выстраивается вокруг зрителя, вовлекая его внутрь экранного мира.
Точка пересечения линийпри обратной перспективенаходится перед картиной, там, где стоит зритель. В двадцатом столетии, начиная с П.Сезанна, развитие живописивновь знаменует возврат к обратной перспективе. Принципы обратной перспективы могут рассматриваться и как зеркальность прямой перспективы, которые были применены режиссёром А. Медведкиным вкинодраме «Счастье» (1934г.). Пространство фильмакак бы выстраивается вокруг зрителя, вовлекая его внутрь экранного мира.
Ещё в эпоху Ренессанса художники заметили, что изображение деформируется, если стоять не напротив картины, а сбоку от неё. Это открытие привело к созданию картин на основе искажённойперспективы(анаморфозы) –намеренного искажения объекта, которыйпри определённых условиях становится узнаваемым(Г. Гольбейн «Французские послы Жан де Дентвиль и Жорж де Сельв»,1533г.). В XVI в.идея деформации образа получает свое воплощение в любопытных экспериментах художников, ставящих своей целью изучение приемов искажения. Эксперименты с перспективой и ее деформациями открывают широкие возможности для конструкции фантастических, ирреальных, искусственных пространственных форм. Искажённая перспектива с парадоксальными формами, ложные панорамы, иллюзии стали базой сюрреализма. В XX–XXI вв.анаморфозы получили своё второе рождение. Наиболее известны в настоящее времяработы Иштвана Ороса. Деформация, искажённая перспектива становится одним из выразительных приемов кинорежиссеров. С. Бондарчук в фильме «Война и мир»использовалоптическое искажение предметов и пространства с цельюизобразитьмир, увиденныйякобы глазами матёрого волка, затравленного охотниками.
Искажённая перспектива с парадоксальными формами, ложные панорамы, иллюзии стали базой сюрреализма. В XX–XXI вв.анаморфозы получили своё второе рождение. Наиболее известны в настоящее времяработы Иштвана Ороса. Деформация, искажённая перспектива становится одним из выразительных приемов кинорежиссеров. С. Бондарчук в фильме «Война и мир»использовалоптическое искажение предметов и пространства с цельюизобразитьмир, увиденныйякобы глазами матёрого волка, затравленного охотниками.
Сферическая перспектива, связанная с округлой формой глазного яблока и периферическим зрением, используется в пейзажной живописи для трактовки земной поверхности (К. Хокусай «Морской путь в Кадзуса»,1831г.;К. ПетровВодкин «Смерть комиссара»,1928г.;Б. Кустодиев «Портрет Ф. И. Шаляпина»,1922г.). В кинематографе она даёт возможность с помощью современных технических средств показать на экране без увеличения его размеров длиномерность конструкций, панорамы открытых пространств и расширить угол обзорасложного ракурса. Благодаря сферической перспективе стало реальным в кинодраме «Час пик» (реж. О. Фесенко, 2006г.) фронтально разместить мост на первом плане кадра, а в «Телефонной будке» (реж. Д.Шумахер, 2003г.) и «Кодеда Винчи» (реж. Р.Ховард, 2006г.) снять сцены в узком пространстве телефонной кабины и в кабине автомашины, также в фантастическом боевике «Стиратель» (реж. Ч. Рассел, 1996г.) и в детективе «Девушка, которая играла с огнём» (реж. Д. Альфредсон, 2009г.) увидеть исследуемые интерьеры как бы через объектив микрои видеокамеры.
Благодаря сферической перспективе стало реальным в кинодраме «Час пик» (реж. О. Фесенко, 2006г.) фронтально разместить мост на первом плане кадра, а в «Телефонной будке» (реж. Д.Шумахер, 2003г.) и «Кодеда Винчи» (реж. Р.Ховард, 2006г.) снять сцены в узком пространстве телефонной кабины и в кабине автомашины, также в фантастическом боевике «Стиратель» (реж. Ч. Рассел, 1996г.) и в детективе «Девушка, которая играла с огнём» (реж. Д. Альфредсон, 2009г.) увидеть исследуемые интерьеры как бы через объектив микрои видеокамеры.
Панорамная перспектива –изображение на картине всего того, что зритель видит вокруг себя. При рассматривании панорам зритель должен находиться в центре круглого помещения, где, как правило, располагают смотровую площадку. Общеизвестными в России являются панорамы «Оборона Севастополя» и «Бородинская битва» в Москвеи «Сталинградская битва» вВолгограде. Панорамное кино –кинематографическая система с сильно изогнутым экраном. Но панорамная перспектива в фильме может создаваться и на обычном экранепри движущейся круговой съёмке вокруг неподвижного объекта(«Мы из будущего–2»,реж. А. Самохвалов, 2010г.).
А. Самохвалов, 2010г.).
Как в живописи, так и в кинематографе цветовоерешение произведений, многообразиепланов,очертания композиции на полотне и в кадре, обозначающиеразные смысловые темы, акцентыили относящиеся к разным временным потокам,проекции и перспективы выстраиваютсяодними и теми же приёмами. Кинематограф строил себя как бесконечная цепочка артпредшествований. Становление кинотворчества связано с обращением к истокам, с имитацией великих мастеров живописи. Исследования изобразительного материала применительно к фильмам вызывают импульс к изучению проблемы выразительности экранного мастерства, способствуют развитию кинематографа как вида искусства.
Elena Skorik,Teacher of Fine Arts of Highest Qualification Category, School № 109, Moscowskorikcrew@yandex. ruAlexander Skorik,
the head of the “Postproduction”department, Moscowskorikcrew@yandex. ruComposite solutions in visual arts and cinemaAbstract. The authors examine the impact of visual arts on the compositional expressiveness of film language and imagery. They determine common roots underlying the cinematic and visual art craftsmanship. Particular attention is drawn to the analogy of artistic techniques in painting with the techniques in the field of cinema such as the color solution works, comparison of spatial plans, the transformation of visual foreshortening and perspectives in the variability of the screen visuality. The material is intended for people, interested in arts, culture and cinema, artists, professionals.
They determine common roots underlying the cinematic and visual art craftsmanship. Particular attention is drawn to the analogy of artistic techniques in painting with the techniques in the field of cinema such as the color solution works, comparison of spatial plans, the transformation of visual foreshortening and perspectives in the variability of the screen visuality. The material is intended for people, interested in arts, culture and cinema, artists, professionals.
Key words: film language, cinematic space, coloration mounting film, foreshortening, perspective.
Рекомендовано к публикации:
Горевым П. М., кандидатом педагогических наук, главным редактором журнала «Концепт»
Композиционное решение витрины | Авторская платформа Pandia.ru
Секрет оформления витрины — в правильном использовании ее пространства. В рекламной практике это требование нередко игнорируется, и тогда мы становимся свидетелями того, как в тесные узкие витрины втискивают громоздкие мебельные товары, а на длинных современных окнах выложены едва заметные издали галантерейные товары: перчатки, сумки, пудреницы. Витрина должна украшать улицу, придавать ей отпечаток богатства и многообразия. Добиться этого можно предельно экономными художественными средствами, акцентируя внимание на рекламном воздействии витрины, а не на “украшении”.
Витрина должна украшать улицу, придавать ей отпечаток богатства и многообразия. Добиться этого можно предельно экономными художественными средствами, акцентируя внимание на рекламном воздействии витрины, а не на “украшении”.
Витринная экспозиция товаров призвана решать три основных задачи. Первая задача состоит в том, чтобы привлечь внимание прохожего к витрине, вторая — заставить его осмотреть товарную выставку и третья — побудить зрителя присмотреться к некоторым из выставленных образцов. Обычно решение этих задач происходит последовательно и достигается правильным использованием при оформлении витрины различных приемов композиции.
Чтобы привлечь внимание, витрина должна обладать так называемой “броскостью”. Это достигается путем создания композиционного центра витрины, который бросается в глаза в первую очередь, а затем уже внимание привлекают остальные элементы в порядке их значимости. Витрина, где отдельным частям придается одинаковое значение, никогда не воспринимается как гармоническое целое; оно лишь утомляет глаз человека, создавая впечатление путаницы и беспорядка.
Композиционный центр витрины можно сделать различными способами: оригинальной группировкой предметов, необычным использованием линий, красок или размерами выставленных товаров. Броскости добиваются также путем привлечения внимания зрителей к пятну, образованному группой ярких товаров или каким-либо декоративным центром. Таким центром может быть юмористический мотив, оригинальный плакат и т. д. Им может стать, например, декоративный самолет, сбрасывающий различные образцы штапельных тканей. Для придания витрине жанрового характера здесь можно поместить фигурки людей, а на небольших плакатах дать описание качества рекламируемых тканей с указанием места продажи их в универмаге.
Чтобы заставить зрителя осмотреть витринную экспозицию, необходимо правильно расположить и сгруппировать товары. Расположение товаров и элементов оформления во всякой витрине должно подчиняться основным правилам композиции, принятым в декоративном искусстве.
Существует три основных принципа композиционной группировки товаров и декоративных элементов.
Первый принцип — соблюдение равновесия (баланса), или симметрии. В этом случае предметы, сходные между собой по объему или внешнему виду, располагаются в строгом соответствии по обе стороны воображаемой средней линии. Фрагменты одной стороны витрины соответствуют аналогичным фрагментам другой стороны.
Центральная осевая симметрия заключается в том, что для всех экспонатов существует один общий центр, вокруг которого группируются все выложенные товары. Осевая симметрия, или симметрия по отношению к линии плоскости, которая делит объем витрины на две равные части, достигается в том случае, если по обеим сторонам размещаются одинаковые предметы или их группы.
Отраженная симметрия — это особый вид осевой симметрии, когда элементы одной стороны содержатся в другой, как бы в зеркальном отражении. В результате получается ряд аналогичных экспонатов с парным количеством элементов, выраженных в едином ритме.
Как правило, оформление симметричной витрины не представляет большой трудности. Даже средняя по художественному уровню витрина создает впечатление единства и целостности. Равновесие достигается тем, что инвентарь и экспонаты сгруппированы таким образом, что обе части витрины создают оптический эффект одинаковой насыщенности. При этом не обязательно, чтобы в каждой из сторон было одинаковое количество экспонатов.
Даже средняя по художественному уровню витрина создает впечатление единства и целостности. Равновесие достигается тем, что инвентарь и экспонаты сгруппированы таким образом, что обе части витрины создают оптический эффект одинаковой насыщенности. При этом не обязательно, чтобы в каждой из сторон было одинаковое количество экспонатов.
В практике часто используют и асимметричное равновесие. Оно заключается в произвольной группировке экспонатов с сохранением общего равновесия. В этом случае крупный предмет расположенный с правой стороны витрины — манекен, “уравновешивается” группой мелких предметов, которые размещаются по левую сторону витрины.
Второй принцип — обеспечение устойчивости. Впечатление устойчивости достигается расширением основания выставки, а также расположением крупных предметов в нижней части витрины в наибольшей удаленности от зрителя. Примером максимальной устойчивости служит пирамида. Устойчивость должна сочетаться с гармонией и плавностью линий. Правильно координированная, динамично размещенная товарная масса производит впечатление легкости и свободы. Это правило особенно важно соблюдать при показе легких тканей.
Правильно координированная, динамично размещенная товарная масса производит впечатление легкости и свободы. Это правило особенно важно соблюдать при показе легких тканей.
Третий принцип — соблюдение ритма. В композиционном решении оформления витрины ритм представляет собой повторение очертаний отдельных предметов или групп товаров, а также повторение расстояний между этими предметами, группами, линиями складок и т. д.
Благодаря такому размещению достигается впечатление принадлежности отдельных элементов единому композиционному плану оформления. Взгляд покупателя не переходит с одного товара на другой, а охватывает всю витрину, которая воспринимается компактно.
Принцип ритмичного чередования элементов имеет большое значение в оформлении витрины мелкими по размеру товарами, например, в галантерейных и парфюмерных магазинах, а также при показе продуктов в фабричной расфасовке, хозяйственных товаров и белья.
Используя принцип ритма, товары в витрине можно располагать в форме круга или зигзага по горизонтальной, вертикальной и наклонной линиям.
От специфики магазина зависит и количество товаров в витринах магазина. Например, при создании витрин продовольственных магазинов следует учитывать особенности торговли этими товарами, которая требует их массового показа. Выкладка в витрине большого количества однородных товаров создает впечатление изобилия.
При оформлении витрин магазинов-салонов, торгующих дорогими товарами, наоборот, нет необходимости насыщать их художественную композицию декоративными элементами.
Для остальной массы магазинов различных профилей обязательными является принцип демонстрации в витрине такого количества образцов товаров, которое давало бы представление об ассортименте. Конкретное количество товаров, выставляемых в витрине, зависит от размеров витрины и размеров экспонатов. Опыт подсказывает, что количество изделий в группе не должно превышать восьми.
Важно соблюдение и такого принципа, как товарное соседство. Несоблюдение его приводит к тому, что покупатель не сразу найдет в витрине то, что его интересует. Чаще всего товарное соседство нарушается в витринах, где размещены мелкие предметы родственных товарных групп. Например, в витринах с косметическими товарами туалетная вода лежит иногда рядом с шампунем и губной помадой. Эту же воду можно увидеть рядом с зубной пастой, а другие виды пасты, в свою очередь, разбросаны по всей витрине.
Чаще всего товарное соседство нарушается в витринах, где размещены мелкие предметы родственных товарных групп. Например, в витринах с косметическими товарами туалетная вода лежит иногда рядом с шампунем и губной помадой. Эту же воду можно увидеть рядом с зубной пастой, а другие виды пасты, в свою очередь, разбросаны по всей витрине.
Подобный ассортиментный хаос бывает и в витринах продовольственных магазинов, где карамель лежит рядом с макаронами; я пачки чая можно увидеть в разных местах. При создании витрин следует помнить, что в непосредственной близости размещают товары одинакового назначения, и для лучшей просматриваемости необходимо оставлять свободное пространство между группами товаров. Важна при этом очередность размещения “островков” товаров одинакового назначения, т. е. логика размещения, основанная на принципе комплексности.
Произвольная выкладка различных товаров дезориентирует покупателя. Нельзя например размещать рядом текстильные и косметические товары или рабочую одежду и женское белье. Товары нужно группировать по принадлежности. В одну группу входят, например, мужские рубашки, галстуки, запонки. Зонтик, женская сумочка, перчатки, носовой платок, флакон духов и пудра составляют другой логично увязанный фрагмент экспозиции.
Товары нужно группировать по принадлежности. В одну группу входят, например, мужские рубашки, галстуки, запонки. Зонтик, женская сумочка, перчатки, носовой платок, флакон духов и пудра составляют другой логично увязанный фрагмент экспозиции.
Группировка товаров по принадлежности создает колорит, привлекательность и позволяет обратить внимание не только на основной товар, но и на сопутствующие товары.
Товары каждой группы должны гармонировать по размеру. Они не должны заслонять друг друга. Для этого более мелкие предметы устанавливают перед крупными. Витрину не следует перегружать большим количеством товарных групп, так как это снижает ее действенность.
2.2 Композиционное решение серии открыток. Разработка серии открыток на тему «Ялтинские коты»
Разработка серии открыток на тему «Ялтинские коты»
курсовая работа
В изобразительном искусстве композиции отводится решающая роль. Любая работа заключает в себе идею. Для воплощения идеи в жизнь, для создания художественного произведения необходима разработка плана— композиции.
Композиция в изобразительном искусстве означает составление и расположение элементов, фигур и частей картины. Композиция — это соединение в единое целое нескольких разнородных частей, в основе которых лежит идея. Композиция должна четко выражать задуманную идею, раскрывать внутреннее содержание художественного произведения путем подчеркивания главного, характерного. Композиция должна отвечать эстетическим требованиям.
Тема художественного произведения определяет композиционное решение. Композиция не должна быть самоцелью художественного произведения. Она должна помочь автору раскрыть содержание и максимально выразить идейный замысел произведения.
При создании композиции важно все: и размер бумаги или холста, и ритмическая последовательность расположения фигур, и использование симметрии или асимметрии, статики и динамики, равновесие, контрасты или нюансы, глубины и пятна. Композиция произведения может строиться как по вертикали, так и по горизонтали. Это зависит от постановки натуры или величины и формы предмета, от точки зрения, с которой рисовать, от задачи, которая ставится.
В изобразительном искусстве композиционных построений может быть великое множество. Композиция может строиться на основе различных геометрических фигур: треугольника, ромба, круга, овала и т. д. Композиция может и не придерживаться никакой определенной геометрической фигуры и строиться на основе самых разнообразных кривых линий. Компоновку любого художественного произведения нужно начинать с поисков и определения композиционного центра, центра визуального интереса. Композиционным центром называется тот предмет, часть предмета или группа предметов, которые расположены в картине так, что первыми бросаются в глаза. Эта часть должна выглядеть особенно значимой. Окружающая область — быть чуть менее заметной.
Необходимо помнить, что композиционный центр не должен находиться в центре картины. Также он не должен занимать половину холста, лучше всего пропорция 1/3. Все должно быть подчинено композиционному центру: величина, форма, расположение всех других частей рисунка. В композиции может быть два композиционных центра, но они не должны конкурировать между собой.
В пейзаже есть одно традиционное правило: небо и ландшафт по композиционной массе должны быть неравны. Если художник ставит своей целью показать простор, беспредельное пространство, он большую часть картины отдает небу и основное внимание уделяет ему же. Если для художника главной задачей является передача подробностей ландшафта, то граница ландшафта и неба в картине обычно располагается значительно выше оптического центра композиции. Если границу расположить посередине, то изображение распадается на две части, равно претендующие на главенство, — нарушится принцип подчиненности второстепенного главному [16,с.95].
Чтобы пейзаж выглядел более реалистичным, следует создать глубину, Для иллюзии трехмерного пространства в композиции делают как минимум три плоскости (передний план, средний и фон), также располагают объекты так, чтобы они перекрывали друг друга. Следует помимо этого помнить, что при работе в живописи текстуры смягчаются при удалении, а цвета расположенные вдали на заднем фоне обычно холоднее и убывают в цвете, чем ближе расположены предметы, тем теплее и насыщеннее выглядят цвета. Контраст и «цветность» намного слабее и постепенно набирают силу к переднему плану. Мягкие грани на заднем плане также способствуют созданию иллюзии глубины в живописи[16.с.22].
Контраст и «цветность» намного слабее и постепенно набирают силу к переднему плану. Мягкие грани на заднем плане также способствуют созданию иллюзии глубины в живописи[16.с.22].
Основное требование, предъявляемое к композиции, — уравновешенность расположения изображаемых предметов на холсте. Компонуя рисунок, надо уравновесить его основную часть относительно краев холста: верхнего, нижнего и боковых. Исследуйте равновесие масс в картине. Работа не будет выглядеть перегруженной, если включить в композицию некоторую «зону отдыха», желательно перед центром интереса. Композиционная выразительность достигается усилением линий и форм, контрастирующих с основными массами. Контрастные сочетания резки, в композиции они выступают на первый план.
Контраст характеризуется несхожестью качеств и признаков противоречивых сторон. В композиции используется множество видов контрастов. Контрастировать между собой могут линии, формы, величины, цвет и т. д. Чем больше будет разница между линиями, формами, величинами, тем выразительнее будет композиция[21,с. 56].
56].
Контрастными являются линии вертикальные и горизонтальные, прямые и кривые, широкие и узкие. Чем больше будет контраст формы по своей массе и объему, тем также выразительнее будет композиция. Если возможно, включите в композицию горизонтальные, вертикальные и диагональные линии. Эти линии не должны присутствовать в чистом виде, но следует придавать с их помощью направление движения. Диагональные предпочтительны потому, что они не идут параллельно краям холста и дают глубину.
Не следует сгибать линии наружу, лучше направлять их внутрь. Также не стоит рисовать горизонтальных и вертикальных линий параллельных краям холста. Нужно избегать длинных прямых линий. Лучше маскировать их или слегка искривлять. Также следует избегать соприкосновения граней.
По какому бы принципу ни была построена композиция картины, она должна отвечать основному требованию — единства всех ее частей и четко выражать идею произведения. Четкий замысел и ясный образ — основа всякой творческой работы. [ 3]
[ 3]
|
⇐ ПредыдущаяСтр 4 из 5Следующая ⇒ В данном контексте композиционное решение относится к понятию «техническая форма», т.е. применительно к объектам утилитарного назначения. Композиция (лат. Compositio) – составление, расположение, структура и взаимосвязь важнейших элементов объекта. В основе композиции технического объекта лежит выбор элементов (или их группы) соподчинённости этих элементов. В качестве элементов выделяют геометрические, светотеневые или цветовые свойства формы объекта. Композиция характеризуется: · категориями: тектоника; объёмно-пространственная структура объекта. · свойствами и качеством: гармоническая целостность формы; соподчинённость; композиционное равновесие; симметрия, асимметрия и их сочетание; динамичность и статичность формы; единство характера формы. · средствами композиции: определяющий композиционный приём; пропорции и масштаб; контраст и нюанс; метр и ритм; тени и пластика. Знание категорий, свойств, качеств и средств композиции позволяет выбрать рациональные приёмы и методы работы над композицией объекта. Рассмотрим основные категории композиции и их взаимосвязь. Тектоника есть зримое отражение работы конструкции и материала в форме. В тектонике выражается связь формы и содержания изделия. Например, литая конструкция имеет такую форму, чтобы однозначно было видно – это литьё, а не сварная или какая-либо иная конструкция. Поэтому говорят о тектонике «литой формы», о тектонике «штампованных элементах», о тектонике «полимерных конструкций» и т.д. Так как конкретный материал конструкции предопределяет композицию всякого изделия, то тектоника – одна из основных категорий. Понятие «тектоника» неразрывно связывает две важнейшие характеристики объекта – его конструктивную основу (материал) и форму во всех её проявлениях (в целом и частном). Конструктивная основа, кроме материала включает силовых элементов конструкции, характер распределения усилий (силовые потоки), соотношение масс и т. Свойства и качества композиции позволяют выделить следующие эстетические показатели объекта: гармоническую целостность формы; соподчинённость элементов; композиционное равновесие элементов; симметрию и асимметрию элементов, и их комбинации; динамичность и статичность элементов, их характер. Гармоническая целостность формы – отражает логику и органические связи конструктивного решения с его композиционным воплощением. Композиция может быть построена на контрасте между сложной, насыщенной тенями структурой открытой части: направляющие, элементы суппорта, ходовые и тяговые винты, органы управления различных наружных элементов, и т.п. и лаконичными, чистыми объёмами несущей части станины, опор станка и крупных формообразующих элементов: механизмов подач, коробок скоростей, несущих стоек, и др. Основное качество – контраст – противопоставление простого и сложного начал. Соподчинённость элементов – определяется закономерностями композиции, которые зависят от вида (характера) объекта. Например: в технологическом оборудовании определяющими являются базовые элементы, несущие основную нагрузку. Их форма определяется прочностью и жесткостью. Лицевая панель пульта управления является фоном, на котором в определённой последовательности и сочетаниях расположены индикаторы и органы управления. Их форма должна иметь определённую информационную сущность: что наблюдать, как нажать, как переключить. Поэтому соподчинённость элементов должна базироваться на схеме связей и необходимой последовательности действий управления. Композиционное равновесие элементов и формы — такое состояние композиции объекта, при котором все элементы сбалансированы между собой. Зрительная композиционная уравновешенность. Композиционное равновесие это простое равенство величин, оно зависит от: · распределения основных масс относительно смыслового центра конструкции; · характера организации пространства, определяемого пропорциями и расположением осей, пластикой формы, цветовыми и тональными отношениями. Примеры: · прибор на стойке – зрительное уравновешивание; · уравновешивание конструкция цветом; · симметрия, асимметрия и их комбинации. Под симметрией (греч. Symmitria – соразмерность) в эстетике понимают гармоничное расположение в пространстве отдельных частей целого, соразмерность и соответствие между ними. Симметрия может быть: зеркальной, центральной, плоскостная и осевая. Гармония симметричной формы видна сразу. Уловить гармонию в асимметричной форме значительно сложнее, но условие целостности асимметричной формы – это её композиционная уравновешенность, которая может быть достигнута за счет комбинаций симметрии и асимметрии. Динамичность и статичность формы. Динамичной называют форму активно односторонне направленную, как бы вторгающуюся в пространство. Статическая форма – подчеркнутое выражение состояния покоя, незыблемости, устойчивости. Здесь следует отметить, что динамичность и статичность формы оценивают по горизонтальной оси, что связано с особенностями восприятия. Единство характера формы – важное свойство композиции, которое определяет единичный подход к формообразованию всех элементов данной формы. Поэтому все объекты одного назначения, мало отличаются друг от друга. Композиция воспринимается, как целое, если она построена из относительно небольшого числа элементов. Поэтому важно, чтобы композиция укладывалась в угол зрения, не превышающий 40°. При работе над формой необходимо учитывать оптические иллюзии, т.е. ложное истолкование размеров и конфигурации предметов при их зрительном восприятии. Оптические иллюзии объясняются главным образом устройством зрительного аппарата человека, его связями с мозгом – чисто физиологическими причинами. Наиболее часто встречающиеся оптические иллюзии. Явление иррадиации. Какой из внутренних квадратов больше? Черный или белый? (рис. 12.4)
Какой круг больше? Тот, который окружен маленькими кругами или же тот, который окружен большими? Они одинаковые (рис. 12.5). Иллюзия Болдуина. Какая линия больше А или Б? (рис. 12.6). Они абсолютно равны, хотя линия Б кажется гораздо длиннее. Приведем еще примеры оптического восприятия (табл. 12.1).
Психологические факторы восприятия – колебания внимания, воображение, глазомер, наблюдательность, абстрактное мышление. Учитывая эффект иррадиации света чередующиеся черные и белые полосы нужно выполнять разной ширины: черные шире белых. Это касается штрихов шкал. Психологические особенности восприятия. горизонтали нежели вертикали; отдаёт предпочтение линиям восходящим слева направо, чем справа налево – нисходящим, точнее оценивает ширину предметов, нежели их высоту или глубину. Правильный учет физиологических и психологических особенностей восприятия позволяет дизайнеру добиваться желаемого воздействия формы и её согласования в композиции. Особенности психологического восприятия цвета: · красный цвет – цвет огня (опасность). Он ассоциируется с теплом и поэтому увеличивает напряжение мышц, кровяное давление и ритм дыхания; имеет стимулирующее влияние и вызывает эмоции; · оранжевый цвет–одновременно и согревающий и стимулирующий; очень яркий; при различной насыщенности может и успокаивать, и раздражать; · желтый цвет–имеет наибольшую светимость в спектре и стимулирует зрение–цвет хорошего настроения. Некоторые тона (желто- зеленые) действуют успокаивающе; · зеленый цвет– успокаивающий способствует отдыху действует освежающе и успокоительно, уменьшает слишком яркое солнечное освещение; · голубой цвет холодный воспринимается как светлый, свежий и прозрачный; обладает успокаивающим действием; · фиолетовый цвет вызывает печаль; · черный цвет–в больших количествах угнетает; очень полезен в небольших количествах, особенно для контрастов. · белый цвет–символ чистоты. Если применяется один или с цветами зелено–голубой части спектра–цвет холодный. С цветами желто–оранжевой части спектра–даёт ощущение тепла. Сигнальное значение цвета. Особо выделены: зелёный, жёлтый и красный. Зелёный – безопасность; жёлтый–предупреждает о возможной опасности; красный–знак опасности и запрета; включение–выключение (Стоп) оборудования; повсеместно – пожарный инвентарь. Синий цвет–используются для элементов графики в производственных помещениях (цехах) и производственной информации. «Растигровка»–жёлтый цвет с чёрными или красными полосами–обозначение опасных подвижных объектов. Белый цвет, заключённый в красный прямоугольник–движущиеся ёмкости со взрывоопасными и вредными веществами. Оранжевый – элементы ограждения машин и механизмов, неосторожное обращение с которыми может привести к трамвам. Символические изображения чёрного цвета на жёлтом фоне применяются для знаков, предупреждающих объект опасности. Красный круг с белым полем внутри, на которой символы чёрного цвета –запрещающие знаки, предписывающие знаки. Основные рекомендации по выбору цветовых решений. При этом принято выделять три основные зоны: рабочее место; рабочую зону; помещение (интерьер) в целом. Рабочее место – соответствует панели управления или части пульта управле- ния, на которой должны быть сосредоточены все наиболее важные органы управления (регуляторы) и контроля (индикаторы). В этой зоне кроме сигнальных (предупреждающих) и вспомогательных цветов, имеющих определённую информативную нагрузку, используются малонасыщенные цвета, в которые окрашиваются поверхности объекта (панели). Зона рабочего места должна иметь наиболее насыщенные в цветовом и яркостном плане элементы объекта. Цвета: сигнальные (предупреждающие) и информативные. Рабочая зона – характеризуется законченным объектом: технологическое обеспечение в целом (станок, пульт управления и т. Помещение в целом характерно тем, что основные его поверхности (стены, пол, потолок; технологическое обеспечение; техническое оборудование; инженерные коммуникации) окрашиваются в цвета, в соответствии с рекомендациями, основанными на специфике того или иного производства, помещения.
Контрольные вопросы 1. Дайте понятие определению техническая эстетика 2. Дайте понятие определению инженерная психология 3. Дайте понятие определению эргономика 4. Методы исследования в эргономике 5. Перечислите комплексные эргономические показатели. 6. Основные эргономические требования к конструкции регуляторов. 7. Основные эргономические требования к рабочему месту. 8. В чем заключается эстетический анализ объекта? 9. Принятие цветовых решений при проектировании технического объекта
⇐ Предыдущая12345Следующая ⇒ |
4.
 3: Состав растворов
3: Состав растворов- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15057
Растворы представляют собой гомогенные смеси , содержащие один или более растворяет в растворителе . Растворитель, составляющий большую часть раствора, тогда как растворенное вещество — это вещество, растворенное внутри растворителя.
Единицы относительной концентрации
Концентрации часто выражаются в относительных единицах (например, в процентах) с обычно используемыми тремя различными типами процентных концентраций:
- Массовые проценты когда дана масса растворенного вещества и масса раствора: \[\text{Процент массы}=\dfrac{\text{Масса растворенного вещества}}{\text{Масса раствора}} \times 100\% \ ярлык{1}\]
- Объемный процент : Объемный процент используется для выражения концентрации раствора, когда объем растворенного вещества и объем раствора заданы: \[\text{Объемный процент}= \dfrac{\text{Объем Раствор}}{\text{Объем раствора}} \times 100\% \label{2}\]
- Процент массы/объема: Другой вариант процентной концентрации — это процент массы/объема, который измеряет массу или вес растворенного вещества в граммах (например, в граммах) по сравнению с объемом раствора (например, в мл).
 Примером может быть 0,9%(мас./об.) раствора \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса. Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)).
Примером может быть 0,9%(мас./об.) раствора \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса. Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)).
\[\text{Масса/объем в процентах}= \dfrac{\text{Масса растворенного вещества (г)}}{\text{Объем раствора (мл)}} \times 100\% \label{3}\ ]
Рисунок использован с разрешения Википедии.
Пример \(\PageIndex{1}\): «Крепость» алкоголя как единица концентрации
Например, в Соединенных Штатах содержание алкоголя в спиртных напитках определяется как двойное процентное содержание алкоголя по объему (об./об.). называется доказательством. Какова концентрация алкоголя в спиртных напитках Bacardi 151 , которые продаются с крепостью 151 (отсюда и название)?
Рисунок: Почти пустая бутылка Bacardi 151. из Википедии.Раствор
Он будет иметь содержание спирта 75,5% (вес/вес) в соответствии с определением «пруф».
При расчете этих процентов единицы измерения растворенного вещества и раствора должны быть эквивалентными единицами (а весовые/объемные проценты (масс./об.%) определяются в граммах и миллилитрах).
| Вы НЕ МОЖЕТЕ подключить… | Вы НЕ МОЖЕТЕ подключить… |
|---|---|
| (2 г растворенного вещества) / (1 кг раствора) | (2 г растворенного вещества) / (1000 г раствора) |
| или (0,002 кг растворенного вещества) / (1 кг раствора) | |
| (5 мл растворенного вещества) / (1 л раствора) | (5 мл растворенного вещества) / (1000 мл раствора) |
| или (0,005 л растворенного вещества) / (1 л раствора) | |
| (8 г растворенного вещества) / (1 л раствора) | (8 г растворенного вещества) / (1000 мл раствора) |
| или (0,008 кг растворенного вещества) / (1 л раствора) |
Единицы концентрации разведения
Иногда, когда растворы слишком разбавлены, их процентная концентрация слишком мала. Таким образом, вместо использования очень низких процентных концентраций, таких как 0,00001% или 0,000000001%, мы выбираем другой способ выражения концентраций. Следующий способ выражения концентраций аналогичен кулинарным рецептам. Например, в рецепте может быть указано, что нужно использовать 1 часть сахара и 10 частей воды. Как вы знаете, это позволяет использовать в уравнении такие количества, как 1 стакан сахара + 10 стаканов воды. Однако вместо того, чтобы использовать количество рецепта «1 часть на десять», химики часто используют частей на миллион , частей на миллиард или частей на триллион для описания разбавленных концентраций.
Таким образом, вместо использования очень низких процентных концентраций, таких как 0,00001% или 0,000000001%, мы выбираем другой способ выражения концентраций. Следующий способ выражения концентраций аналогичен кулинарным рецептам. Например, в рецепте может быть указано, что нужно использовать 1 часть сахара и 10 частей воды. Как вы знаете, это позволяет использовать в уравнении такие количества, как 1 стакан сахара + 10 стаканов воды. Однако вместо того, чтобы использовать количество рецепта «1 часть на десять», химики часто используют частей на миллион , частей на миллиард или частей на триллион для описания разбавленных концентраций.
- Части на миллион : Концентрация раствора, содержащего 1 г растворенного вещества и 1000000 мл раствора (так же, как 1 мг растворенного вещества и 1 л раствора), создаст очень маленькую процентную концентрацию. Поскольку раствор, подобный этому, был бы очень разбавленным, плотность раствора хорошо аппроксимируется плотностью растворителя; для воды это 1 г/мл (но будет отличаться для разных растворителей).
 Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
- Частей на миллиард : Частей на миллиард (ppb) почти как ppm, за исключением того, что 1 ppb в 1000 раз более разбавлен, чем 1 ppm. \[\text{1 ppb} = \dfrac{1\; \mu \text{g раствор}}{\text{1 л раствора}}\]
- Части на триллион : Как и в случае с ppb, идея частей на триллион (ppt) аналогична концепции частей на миллион.
 Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]
Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]
Пример \(\PageIndex{2}\): частей на миллион в атмосфере
Вот таблица с объемными процентами различных газов, содержащихся в воздухе. Объемный процент означает, что на 100 л воздуха приходится 78,084 л азота, 20,946 л кислорода, 0,934 л аргона и так далее; Объемный процент массы отличается от состава по массе или состава по количеству молей.
| Название элемента | Объемный процент (об./об.) | частей на миллион (об/об) |
|---|---|---|
| Азот | 78. 084 084 | 780 840 |
| Кислород | 20,946 | 209 460 |
| Водяной пар | 4,0% | 40 000 |
| Аргон | 0,934 | 9 340 |
| Углекислый газ | 0,0379 | 379* (но быстро растет) |
| Неон | 0,008 | 8,0 |
| Гелий | 0,000524 | 5,24 |
| Метан | 0,00017 | 1,7 |
| Криптон | 0,000114 | 1,14 |
| Озон | 0,000001 | 0,1 |
| Моноксид азота | 0,00003 | 0,305 |
Единицы концентрации, основанные на молях
- Мольная доля : Мольная доля вещества – это доля всех его молекул (или атомов) от общего числа молекул (или атомов).
 Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\]
Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\] - Мольные проценты : Мольные проценты (вещества A) выражены \(\chi_A\) в виде процентов. \[\text{Молярный процент (вещества A)}= \chi_A \times 100\%\]
- Молярность : Молярность (M) раствора используется для представления количества молей растворенного вещества на литр раствора. \[M= \dfrac{\text{Моли растворенного вещества}}{\text{Литры раствора}}\]
- Моляльность : Моляльность (m) раствора используется для представления количества молей растворенного вещества на килограмм растворителя. \[m= \dfrac{\text{Моли растворенного вещества}}{\text{Килограммы растворителя}}\]
 50 мл дистиллированной воды (0 М), раствор гидроксида натрия 0,1 М и раствор соляной кислоты 0,1 М из group4swimmingpool.
50 мл дистиллированной воды (0 М), раствор гидроксида натрия 0,1 М и раствор соляной кислоты 0,1 М из group4swimmingpool.Уравнения молярности и моляльности отличаются только своими знаменателями. Однако это огромная разница. Как вы помните, объем зависит от температуры. При более высоких температурах объемы жидкостей увеличиваются, а при более низких температурах объемы жидкостей уменьшаются. Поэтому молярности растворов также различаются при разных температурах. Это создает преимущество использования моляльности над молярностью. Использование моляльностей, а не молярностей для лабораторных экспериментов лучше всего удерживает результаты в более близком диапазоне. Поскольку объем не является частью его уравнения, моляльность не зависит от температуры.
Пример \(\PageIndex{1}\)
В растворе содержится 111,0 мл (110,605 г) растворителя и 5,24 мл (6,0508 г) растворенного вещества. Найдите массовый процент, объемный процент и массовый/объемный процент растворенного вещества.
Раствор
Процент по массе
= (Масса растворенного вещества) / (Масса раствора) x 100%|
=(6,0508г) / (110,605г + 6,0508г) x 100%
=(0,0518688312) x 100%0025
Объемный процент
= (Объем растворенного вещества) / (Объем раствора) x 100 %
= (5,24 мл) / (111,0 мл + 5,24 мл) x 100 %
= (0,04507
%)=4,507
9%
Объемный процент = 4,51%
Масса/объемный процент
= (масса растворенного вещества) / (объем раствора) x 100% ) x 100 %
= (0,0520) x 100 %
= 5,205 %
Процент массы/объема = 5,2054 %
Пример \(\PageIndex{2}\)
Используя раствор, показанный на рисунке ниже, найдите молярный процент вещества C. (1mol C / 6.022×10 23 C molecules) = 8.30288941×10 — 24 mol C
Total Moles= (24 molecules) x (1mol / 6.022×10 23 molecules)= 3.98538691×10 — 23 моль всего
X C = (8,30288941×10 — 24 моль C) / (3,98538691×10 — 23 моль) = . 2083333333
2083333333
Процентный процент C
= X7 C4343434343888888888888). 100%
= 20,83333333
Моль Процент C = 20%
Пример \(\PageIndex{3}\)
1,5 л воды состоит из 0,25 г NaCl. Найдите его молярность.
Раствор
Моль NaCl = (0,25 г) / (22,99 г + 35,45 г) = 0,004277 моль NaCl
Молярность
= (моль растворенного вещества) / (литры раствора)
= (0,004277MOL NaCl) / (1,5 л)
= 0,002851 М
Molarity = 0,0029M
. PageIndex{4}\) 0,88 г NaCl растворяют в 2,0 л воды. Найдите его моляльность. Моль NaCl= (0,88 г) / (22,99 г + 35,45 г) = 0,01506 моль NaCl Масса воды = (2,0 л) x (1000 мл / 1 л) x (1 г / 1 мл) x (1 кг) / 1000 г) = 2,0 кг воды Моляльность = (Моли растворенного вещества) / (кг растворителя) = (0,01506 моль NaCl) / (2,0 кг) = 0,00752 м Моляльность = 90 4.3: Композиция Решений распространяется по незаявленной лицензии и была создана, изменена и/или курирована LibreTexts. Твердые растворы являются основой для большинства промышленных сплавов. В одном из ранних обзоров по твердым растворам в 1925 г. Бруни 1 поднял предварительный вопрос: продолжает ли химическая молекула существовать в кристаллическом состоянии? Этот вопрос в настоящее время выглядит довольно наивным, но ответ на него должен быть дан в его время, так как большинство металлов основаны на твердых растворах и все они имеют определенный химический состав, как и любое молекулярное вещество, химия которого заключена в молекулярной структуре. Первые результаты рентгеновских анализов по Брэггу 2 ответил на этот вопрос отрицательно, утверждая, что внутри кристаллического строения существуют только атомы, а молекула исчезает в решетке. Однако структурное происхождение химических составов промышленных сплавов остается открытым. Ключ к пониманию тайны состава должен лежать в структуре твердых растворов, которая была горячей темой в начале двадцатого века. Брэгг и Уильямс были одними из первых, кто предложил статистическую модель, которая рассматривает порядок и беспорядок в твердых растворах как совместное явление дальнего действия 3 . $$\alpha_{{\text{i}}} = 1 — \frac{{n_{i}}}{{m_{B} c_{i} }}$$ (1) где n i – число атомов B среди c i атомов i -й оболочки, а m B – доля атомов B в молях A Бинарный сплав –Б. Уравнения для параметра дальнего порядка Брэгга и Вильямса получаются при рассмотрении предельного случая i очень большим. С тех пор хорошо известно, что ближний порядок является основной структурной особенностью твердых растворов. В попытке исследовать происхождение состава, подразумеваемое такими упорядоченными и неупорядоченными локальными структурами, наша команда занималась разработкой так называемой модели кластера плюс атома клея 6,7,8 , которая упрощает любую краткосрочную модель. Однако, несмотря на доказанную способность модели «кластер плюс атом клея» интерпретировать происхождение состава сплавов, существует очевидный разрыв между идеализированными формулами (например, ближайшие соседи всегда полностью заняты атомами растворителя, такими как [Zn-Cu 12 ]Zn 4 ) и реальный химический ближний порядок (ближайшие соседи всегда смешанно-заселенные), который можно измерить, например, с помощью параметра α и . Сначала мы кратко рассмотрим основы, которые приводят к химическим единицам, как подробно описано в ссылке 7 . Ближний порядок формируется за счет экранирования заряда вокруг любого данного атома, что создает колебательное распределение электронной плотности, а именно осцилляции Фриделя 9{{3}}\), ощущаемый электронами на радиальном расстоянии r , периодически затухает в третьей степени r , где k F волновой вектор Ферми. (2) where R A/M and R B/M are respectively the ratios of R A and R B over \ (R_{M} = (n_{1} \cdot R_{B} + (12 — n_{1} ) \cdot R_{A} )/12\). Обычно принимаются радиусы атомов Гольдшмидта. Когда R A = R B , x + y = 3, что означает 16-атомную кластерную формулу растворителя, равного или радиально-атомного твердого раствора ГЦК [А–Б 12 ](А,В) 3 . Как показано в ссылках 7,14,15 , составы широко используемых промышленных сплавов, таких как сплавы меди, сплавы алюминия, нержавеющие стали и суперсплавы на основе никеля, близки к предсказаниям модели, подтверждая наличие простых химических единиц. Now we show the two basic procedures towards constructing the chemical unit with formula [A–B n 1 A c 1- n 1 ]A x B y с использованием параметра ближнего порядка α 1 . Определение ближайших атомов с использованием α 1 Для данного сплава с известной атомной долей В m B и координационным числом c 1 число атомов В в ближайшей оболочке n 1 равно 3,8 n полученное непосредственно с использованием измеренного значения α 1 по формуле (1): $$n_{1} = m_{B} \cdot c_{1} \cdot \left( {1 — \alpha_{1} } \right)$$ (3) п 1 значение должно быть аппроксимировано ближайшим целым числом. Расчет атомов клея следующего соседа по уравнению. (2) Путем введения в формулу. 2) атомные отношения R A/M и R B/M , установлена связь между x и y . Это соотношение должно согласовываться и с составом сплава, т.е.0470 г ) = м Б . Для FCC решение ( x , y ) также ограничено 0 < x + y < 6. получают два набора близких целых чисел, так что измеренный состав сплава находится между двумя химическими единицами. Эти процедуры будут подробно описаны при анализе типичных примеров популярных бинарных медных сплавов в следующем. Хотя промышленные бинарные сплавы Cu-Zn охватывают диапазон цинка до ~ 40 % масс., Cu-30Zn или патронная латунь является наиболее широко используемой маркой. Параметры α и , достигающие нескольких десятков оболочек, точно измерены в монокристалле Cu 68,9 Zn 31,1 методом упругой дифракции нейтронов с использованием изотопов 65 3,9 3 1 1 Cu в широком интервале взаимообратных реакций. На протяжении всей статьи число в нижнем индексе после элемента указывает на атомную долю или процентное содержание, а число перед элементом представляет собой весовой процент. Измеренное α 1 = − 0,137 указывает на то, что элемент в центре кластера имеет тенденцию быть ближайшим соседом другого элемента, что согласуется с отрицательной энтальпией смешения (Δ H Cu-Zn = − 6 кДж /моль) 18 . Во-первых, число атомов Cu n 1 в оболочке ближайшего соседа рассчитывается как α 1 по уравнению. (3): n 1 = 0,689·12·(1 + 0,137) = 9,40, что далее округляется до целого числа 10 в соответствии с режимом отрицательного взаимодействия между Zn и Cu. Тогда химическая единица принимает вид [Zn-Cu 10 Zn 2 ]Zn x Cu y с M = Cu 10/12 20 Во-вторых, отношение между x и y рассчитывается путем введения R Zn/M и R Cu/M в уравнение (2): 1,23 x + 0,96 y = 4,53. In Cu 85 Al 15 , α 1 = − 0,17 измеряется диффузным рентгеновским излучением в диапазоне углов от 8° до 60° 21 21 приводит к n 1 = 11,93 ≈ 12 и к химической единице [Al-Cu 12 ]Al x Cu y 1 1. При использовании R Al = 1,43 Å и R Al/Cu = 1,12 и в соответствии с составом сплава ( x , y ) решение (1,69, 3,23) и близкие целые числа (2, 3) и (1, 4). Химическая единица корпоспомингах-[Al-cu 12 ] AL 2 CU 3 = CU 15 AL 3 = CU 83,33 AL 16. в CU 80 NI 20 , значение α 1 , как измерено по рассеянию нейтрона+ 65 , примерное рассеяние. склонность одного и того же элемента к соседству. Количество атомов Cu в ближайшей оболочке, рассчитанное с использованием α 1 равно 10 и соответствующая химическая единица [Cu-Cu 10 Ni 2 ]Cu x Ni 1, Используя R Ni = 1,25 Å, близкие целые ( x , y ) решения представляют собой (2, 1) и (1, 2), что соответствует химическим единицам [Cu-Cu 10 Ni 2 ]Cu 2 Ni 1 = Cu 13 Ni 3 = Cu 81,25 Ni 18,75 = CU-17,57NI и [CU-CU 10 NI 2 ] CU 1 NI 4 = CU 12 NI 4 = CU 12 NI 4 = CU 12 NI 4 = CU 12 NI 4 = CU 12 NI 4 = CU 12 ni 4 = CU 23. In Cu 89,1 Be 10,9 сплав, α 1 = + 0,077, измерено с помощью диффузионного рентгеновского рассеяния, что свидетельствует о соседстве одного и того же элемента 3 2. В рамках [CU-M 12 ] CU x BE y , количество атомов CU N 1 составляет 10,79 Ascald от n 1 . в целое число 11. Используя M = Cu 11/12 Be 1/12 и R Be = 1,13 Å, близкое целое ( x , y ) решение равно (2, 1) и (3, 0), что приводит к химическим единицам [Cu- CU 11 BE 1 ] CU 2 BE 1 = CU 14 BE 2 = CU 87,50 BE 12,50 = CU 87,50 BE 12,50 87,50 BE 12,50 87,50 BE 12,50 87,50 1 ]Cu 3 = Cu 15 Be 1 = Cu 93,75 Be 6,25 = Cu-0,94. Следует подчеркнуть, что все приведенные выше примеры сплавов относятся к промышленным маркам, наиболее часто используемым в каждой системе сплавов. Дополнительные примеры приведены в таблице 1, где большинство химических единиц объясняют общепринятые промышленные спецификации. Исключение составляют формулы для сплавов Ni 80 Cu 20 и Ni 60 Cu 40 , что свидетельствует о том, что не все формулы соответствуют хорошим сплавам, но верно и обратное: широко используемые промышленные сплавы всегда удовлетворяют специфическим кластерным формулам, т.к. это необходимо для достижения состояний гомогенизации растворенных веществ. Полноразмерная таблица Следует напомнить, что параметры ближнего порядка, такие как параметр Коули α, чувствительны к параметрам обработки, особенно к температуре 27 . В принципе, параметры ближнего порядка следует измерять в сплавах, отожженных вблизи критической температуры, когда дальний порядок полностью исчезает и атомное распределение стремится к стохастически стабильному 28,29 . Однако критическая температура в данном сплаве обычно неизвестна. Следовательно, измеренные параметры α следует более правильно рассматривать как тенденцию, по которой атомы распределяются между ближайшими соседними узлами и ближайшими соседними связующими узлами в молекулярно-подобной химической единице. Поэтому, например, латунь Cu-30Zn также можно связать с кластерной формулой [Zn-Cu 12 ]Zn 4 , как мы ранее предлагали 7 , что можно рассматривать как крайний случай, когда отрицательное модель взаимодействия Zn и Cu полностью соблюдается, хотя эта формула эквивалентна [Zn-Cu 10 Zn 2 ]Zn 2 Cu 2 рассчитано по измеренному α 1 . Наконец, следует подчеркнуть, что настоящая работа представляет собой комбинацию нашей теоретической модели с измеримыми параметрами, такими как хорошо зарекомендовавший себя коэффициент Коули α 1 . Это усилило способность нашей модели интерпретировать составы сплавов. Однако подход, развиваемый в настоящей работе, не может быть легко распространен на многокомпонентные системы (здесь мы ограничиваемся только бинарными системами), где как теоретическое описание, так и экспериментальное измерение ближнего порядка весьма затруднены. Отмечено, что в последнее десятилетие возрождаются исследования ближнего порядка, особенно в высокоэнтропийных сплавах 30,31,32,33 . Информация, полученная с помощью сложных методов измерения и компьютерного моделирования, несомненно, обогатит наши знания о химическом ближнем упорядочении. Нашей будущей целью должно стать использование современных данных для работы со сложными по составу сплавами. Подводя итог, можно сказать, что после объединения измеренных параметров ближнего порядка с нашей моделью «кластер плюс атом клея» мы можем построить химические единицы, подобные молекулам, которые интерпретируют состав существующих промышленных сплавов в соответствии со стандартными марками. Авторы заявляют, что основные данные, подтверждающие результаты этого исследования, содержатся в документе. Все остальные соответствующие данные можно получить у соответствующего автора по обоснованному запросу. Бруни Г. Твердые растворы. Хим. 1 , 345 (1925). КАС
Статья
Google ученый Брэгг, У. Х. Значение кристаллической структуры. J. Chem. соц. Транс. 121 , 2766–2787 (1922). КАС
Статья
Google ученый Брэгг В. Л. и Уильямс Э. ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Бете, Х. А. Статистическая теория сверхрешеток. Проц. Р. Соц. Лонд. А 150 , 552–575 (1935). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Коули, Дж. М. Приближенная теория порядка в сплавах. Физ. 77 , 669–675 (1950). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Донг, К. и др. От кластеров к фазовым диаграммам: правила состава квазикристаллов и объемных металлических стекол. J. Phys. D. 40 , R273 (2007). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Донг Д., Ван К., Донг К. и Них Т. Молекулоподобные химические соединения в металлических сплавах. наук. Китай Матер. 20 , 1–9 (2021). Google ученый Jiang, B., Wang, Q., Dong, C. & Liaw, P. Исследование эволюции фазовой структуры, вызванной легирующими элементами в сплавах Ti, с помощью модели кластеров химического ближнего порядка. Науч. Респ. 9 , 3404 (2019). ОБЪЯВЛЕНИЯ
Статья
Google ученый Harrison, W. Теория твердого тела (McGraw-Hill, 1970). Google ученый Фридель Дж. Электронная структура первичных твердых растворов в металлах. Доп. физ. 3 , 446-507 (1954). ОБЪЯВЛЕНИЯ
Статья
Google ученый Friedel, J. Металлические сплавы. Нуово Чименто 7 , 287–311 (1958). Артикул
Google ученый Häussler, P. Взаимосвязи между атомными и электронными структурами — жидкие и аморфные металлы как модельные системы. Физ. Отчет 222 , 65–143 (1992). ОБЪЯВЛЕНИЯ
Статья
Google ученый Хан, Г. и др. Значения e/a идеальных металлических стекол по отношению к формулам кластеров. Acta Mater. 59 , 5917–5923 (2011). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Чен, К., Ван, К., Донг, К., Чжан, Ю. и Донг, Х. Правила состава монокристаллических жаропрочных сплавов на основе никеля и их влияние на свойства ползучести с помощью кластерной формулы. наук. Отчет 10 , 21621 (2020). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Вен, Д. и др. Разработка нержавеющих сталей Fe-25Cr-22Ni для оболочек твэлов с высокой микроструктурной стабильностью путем легирования Mo/Nb/Ti/Ta/W. Матер. науч. англ. А 719 , 27–42 (2018). КАС
Статья
Google ученый Ма, Ю. и др. Новый магнитно-мягкий многоэлементный сплав на основе В2 с равномерным распределением когерентных объемно-центрированных кубических нанопреципитатов. Доп. Матер. 33 , 2006723 (2021). КАС
Статья
Google ученый Райнхард Л., Шёнфельд Б., Косторц Г. и Бюрер В. Ближний порядок в α-латуни. Физ. Ред. B 41 , 1727–1734 (1990). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Такеучи, А. и Иноуэ, А. Классификация объемных металлических стекол по разнице в размерах атомов, теплоте смешения и периоду составляющих элементов и ее применение для характеристики основного легирующего элемента. Матер. Транс. 46 , 2817–2829 (2005). КАС
Статья
Google ученый Гаскелл П. О плотности стекол переходный металл-металлоид. Акта Металл. 29 , 1203–1211 (1981). Google ученый Дэвис, Дж. Р. Справочник ASM, том 2: Свойства и выбор: цветные сплавы и материалы специального назначения (ASM International, 1998). Кулиш Н., Петренко П. Ближний порядок в бинарных твердых растворах. Порядок и его изменение при нагреве в сплавах Fe-Al, Cu-Al и Ag-Al. Физ. Статус Solidi A 120 , 315–326 (1990). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Вриен, Дж. и Раделаар, С. Кластеризация в сплавах Cu-Ni: исследование диффузного рассеяния нейтронов. Физ. Rev. B. 17 , 409–421 (1978). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Ку, Ю., Коэн, Дж., Шапиро, С. и Таннер, Л. Закалка АС Cu-10,9 ат.% Be. Акта Металл. 36 , 591–604 (1988). КАС
Статья
Google ученый Schweika, W. & Haubold, H. Рассеяние нейтронов и исследование методом Монте-Карло ближнего порядка и взаимодействия атомов в Ni 0,89 Cr 0,11 . Физ. Rev. B. 37 , 9240–9248 (1988). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Бокоч С.М., Татаренко В.А. Межатомные взаимодействия в ГЦК сплавах Ni-Fe. Усп. Физ. Встретились. 11 , 413–450 (2010). КАС
Статья
Google ученый Jiang, X., Ice, G.E., Sparks, C.J., Robertson, L. & Zschack, P. Локальный атомный порядок и смещения отдельных пар Fe 46,5 Ni 53,5 и Fe 22,5 7 Ni из исследований диффузного рассеяния рентгеновских лучей. Физ. Rev. B. 54 , 3211–3226 (1996). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Чжан Р. и др. Ближний порядок и его влияние на среднеэнтропийный сплав CrCoNi. Природа 581 , 283–287 (2020). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Коули, Дж. М. Параметры ближнего и дальнего порядка в неупорядоченных твердых растворах. Физ. Ред. 120 , 1648–1657 (1960). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Садиг, Б. и др. Ближний порядок и фазовая стабильность поверхностных сплавов: PdAu на Ru (0001). Физ. Преподобный Летт. 83 , 1379–1382 (1999). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Сингх П., Смирнов А. В. и Джонсон Д. Д. Атомный ближний порядок и зарождающийся дальний порядок в высокоэнтропийных сплавах. Физ. Ред. В. 91 , 224204 (2015). ОБЪЯВЛЕНИЯ
Статья
Google ученый Чен, X. и др. Прямое наблюдение химического ближнего порядка в среднеэнтропийном сплаве. Природа 592 , 712–716 (2021). ОБЪЯВЛЕНИЯ
КАС
Статья
Google ученый Сингх Р., Шарма А., Сингх П., Баласубраманиан Г. и Джонсон Д. Д. Ускорение вычислительного моделирования и проектирования высокоэнтропийных сплавов. Артикул
Google ученый Костюченко Т., Рубан А. В., Нойгебауэр Дж., Шапеев А., Крманн Ф. Ближний порядок в гранецентрированных кубических сплавах VCoNi. Физ. Преподобный Матер. 4 , 113802 (2020). Скачать ссылки Настоящая работа была поддержана Фондом естественных наук Китая (51801017), Ключевой дисциплиной и крупным проектом Даляньского фонда инноваций в области науки и технологий (2020JJ25CY004) и Фондом предметного развития ключевых Лаборатория физики и химии поверхности (XKFZ201706). Ключевая лаборатория модификации материалов лазерным, ионным и электронным пучком (Даляньский технологический университет), Министерство образования, Далянь, 116024, Китай Чжуан Ли, Цин Ван и Чуанг Dong Колледж физических наук и технологий Даляньского университета, Далянь, 116622, Китай Dandan Dong Научно-техническая лаборатория физики и химии поверхности, Мяньян, 621907, Китай Lei Zhang Школа материаловедения и инженерии, Университет Далян Цзиотонг, Даляни, 116028, Китай Shuang Zhang & Chuang Dong Авторажи Вы также можете искать этого автора в
PubMed Google Scholar Просмотр публикаций автора Вы также можете искать этого автора в
PubMed Google Академия Посмотреть публикации автора Вы также можете искать этого автора в
PubMed Google Scholar Посмотреть публикации автора Вы также можете искать этого автора в
PubMed Google Scholar Просмотр публикаций автора Вы также можете искать этого автора в
PubMed Google Scholar Посмотреть публикации автора Вы также можете искать этого автора в
PubMed Google Scholar Z. Дандан Донг. Авторы заявляют об отсутствии конкурирующих интересов. Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности. Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Перепечатка и разрешения Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое. Выпуск 3, 2022 г. Из журнала: Раствор
Ссылки
 Общая химия: принципы и современные приложения. 8-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2002. 528-531
Общая химия: принципы и современные приложения. 8-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2002. 528-531 На этой странице нет тегов.
Формулы состава твердорастворных сплавов, полученные из химико-ближнего порядка
Реферат
 Однако связи между характерными для них ближними порядками и химическим составом не установлены. В настоящей работе параметр Коули α сочетается с нашей моделью кластер плюс атом клея для точного определения химических единиц бинарных сплавов твердого раствора гранецентрированного кубического типа. Химическая единица несет информацию об атомной структуре и химическом составе, что объясняет преобладающие промышленные сплавы. Например, химические единицы в Cu 68,9 Zn 31,1 сплав с α 1 =-0,137 составлены как [Zn-CU 10 Zn 2 ] ZN 2 ZN 2 ] 2 2 2 ] 2 2 ]. 2 ]Zn 3 Cu 1 , с 64,0–70,0 мас.% Cu, что соответствует наиболее широко используемой патронной латуни C26000 (68,5–71,5 Cu). Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах.
Однако связи между характерными для них ближними порядками и химическим составом не установлены. В настоящей работе параметр Коули α сочетается с нашей моделью кластер плюс атом клея для точного определения химических единиц бинарных сплавов твердого раствора гранецентрированного кубического типа. Химическая единица несет информацию об атомной структуре и химическом составе, что объясняет преобладающие промышленные сплавы. Например, химические единицы в Cu 68,9 Zn 31,1 сплав с α 1 =-0,137 составлены как [Zn-CU 10 Zn 2 ] ZN 2 ZN 2 ] 2 2 2 ] 2 2 ]. 2 ]Zn 3 Cu 1 , с 64,0–70,0 мас.% Cu, что соответствует наиболее широко используемой патронной латуни C26000 (68,5–71,5 Cu). Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах.
Введение
 Затем эта модель была расширена Бете 4 до более сложной теории, предполагающей короткодействующее взаимодействие в ближайших окрестностях. Дальний и ближний порядок хорошо объединены в параметрах ближнего порядка Коули 5 α i , выражающих взаимодействие данного атома А с атомами i -й оболочки атомов, окружающих его :
Затем эта модель была расширена Бете 4 до более сложной теории, предполагающей короткодействующее взаимодействие в ближайших окрестностях. Дальний и ближний порядок хорошо объединены в параметрах ближнего порядка Коули 5 α i , выражающих взаимодействие данного атома А с атомами i -й оболочки атомов, окружающих его : порядок диапазона в локальную единицу, охватывающую кластер ближайшего соседа плюс несколько атомов клея следующего соседа, выраженную в форме формулы кластера как [кластер] (атомы клея). Эта структурная единица, демонстрирующая нейтральность заряда и среднюю плотность после осцилляции Фриделя 9 , во многом напоминает химические молекулы и в дальнейшем называется «химической единицей» 7 . Единственное отличие от общепринятого понятия молекулы заключается в способе разделения химических звеньев: вместо относительно слабых межмолекулярных сил между молекулами здесь химические звенья связаны химической связью. Анализируя многие промышленные сплавы, мы показали, что все популярные сплавы основаны на простых формулах кластер плюс атом клея, таких как [Zn-Cu 12 ]Zn 4 для Cu-30Zn, [Ni-Fe 12 ]Cr 2 (Ni,Nb,Ti) для мартенситностареющей нержавеющей стали Custom465 и т. д. 7 .
порядок диапазона в локальную единицу, охватывающую кластер ближайшего соседа плюс несколько атомов клея следующего соседа, выраженную в форме формулы кластера как [кластер] (атомы клея). Эта структурная единица, демонстрирующая нейтральность заряда и среднюю плотность после осцилляции Фриделя 9 , во многом напоминает химические молекулы и в дальнейшем называется «химической единицей» 7 . Единственное отличие от общепринятого понятия молекулы заключается в способе разделения химических звеньев: вместо относительно слабых межмолекулярных сил между молекулами здесь химические звенья связаны химической связью. Анализируя многие промышленные сплавы, мы показали, что все популярные сплавы основаны на простых формулах кластер плюс атом клея, таких как [Zn-Cu 12 ]Zn 4 для Cu-30Zn, [Ni-Fe 12 ]Cr 2 (Ni,Nb,Ti) для мартенситностареющей нержавеющей стали Custom465 и т. д. 7 . Параметр α и описывает статистическое отклонение от среднего состава сплава в каждой оболочке повторного циферблата. Отклонение состава проявляется наиболее заметно у первого и второго ближайших соседей, что полностью согласуется с картиной модели кластер плюс атом клея, которая также охватывает тот же радиальный диапазон. Настоящая работа является нашей первой попыткой восполнить пробел, показав, как связаны измеряемые параметры α и , в рамках модели кластер плюс атом клея, к построению формул состава типичных бинарных сплавов твердых растворов с гранецентрированной кубической (ГЦК) структурой.
Параметр α и описывает статистическое отклонение от среднего состава сплава в каждой оболочке повторного циферблата. Отклонение состава проявляется наиболее заметно у первого и второго ближайших соседей, что полностью согласуется с картиной модели кластер плюс атом клея, которая также охватывает тот же радиальный диапазон. Настоящая работа является нашей первой попыткой восполнить пробел, показав, как связаны измеряемые параметры α и , в рамках модели кластер плюс атом клея, к построению формул состава типичных бинарных сплавов твердых растворов с гранецентрированной кубической (ГЦК) структурой. Теоретические методы
 Это колебательное поведение электронов, в свою очередь, вызывает такое же колебание атомной плотности 90 470 г 90 471 (90 470 r 90 471 ) в реальном пространстве, которое заметно в коротком диапазоне 90 470 r 90 471, особенно в ближайших и следующих за ближайшими окрестностях. Местная химическая единица определяется с использованием расстояния отсечки нейтрального заряда, равного 1,76·9.0470 λ Fr , λ Fr = π/ k F ближайшие атомы-кластеры окружают длину волны Фриделя. Для структуры FCC ее модель кластера плюс атома клея показана на рис. 1b, кластер представляет собой кубооктаэдр с координационным числом 12, а оболочка атома клея в соседней окрестности представляет собой октаэдр с координацией 6. Твердый раствор тогда рассматривается как случайная упаковка таких единиц, как схематично показано на рис. 1a. Химическая единица бинарной системы A–B выражается в форме кластерной формулы как [AM 12 ] A x B y , где M 12 = B N 1 A 12- N 1 A 12- N 1 A 12- N 1 A 0 NALERSERSERSEREST ALLES.
Это колебательное поведение электронов, в свою очередь, вызывает такое же колебание атомной плотности 90 470 г 90 471 (90 470 r 90 471 ) в реальном пространстве, которое заметно в коротком диапазоне 90 470 r 90 471, особенно в ближайших и следующих за ближайшими окрестностях. Местная химическая единица определяется с использованием расстояния отсечки нейтрального заряда, равного 1,76·9.0470 λ Fr , λ Fr = π/ k F ближайшие атомы-кластеры окружают длину волны Фриделя. Для структуры FCC ее модель кластера плюс атома клея показана на рис. 1b, кластер представляет собой кубооктаэдр с координационным числом 12, а оболочка атома клея в соседней окрестности представляет собой октаэдр с координацией 6. Твердый раствор тогда рассматривается как случайная упаковка таких единиц, как схематично показано на рис. 1a. Химическая единица бинарной системы A–B выражается в форме кластерной формулы как [AM 12 ] A x B y , где M 12 = B N 1 A 12- N 1 A 12- N 1 A 12- N 1 A 0 NALERSERSERSEREST ALLES. x + y представляет количество атомов клея с 0 < x + y <6.
x + y представляет количество атомов клея с 0 < x + y <6. в металлических сплавах и общность кластерного формулизма. Наша недавняя работа 16 показывает, что модель также применима к высокоэнтропийным сплавам после соответствующей элементной классификации. Аналогично можно рассматривать и твердые растворы гексагонального типа с закрытой упаковкой, поскольку они имеют такое же координационное число, равное 12 (ближайший кластер — сдвоенный октаэдр), и также являются плотно упакованными. Объемно-центрированную кубическую структуру с ромбододекаэдрическим кластером с координационным числом 14 и неплотной упаковкой следует рассматривать отдельно, работа над которой продолжается.
в металлических сплавах и общность кластерного формулизма. Наша недавняя работа 16 показывает, что модель также применима к высокоэнтропийным сплавам после соответствующей элементной классификации. Аналогично можно рассматривать и твердые растворы гексагонального типа с закрытой упаковкой, поскольку они имеют такое же координационное число, равное 12 (ближайший кластер — сдвоенный октаэдр), и также являются плотно упакованными. Объемно-центрированную кубическую структуру с ромбододекаэдрическим кластером с координационным числом 14 и неплотной упаковкой следует рассматривать отдельно, работа над которой продолжается. Когда параметр ближнего порядка α 1 отрицателен, целое число представляет собой округление n 1 , поскольку атомы B имеют тенденцию к обогащению в ближайшей соседней оболочке из-за режима притяжения между центральный атом А и соседние атомы В. В качестве альтернативы, когда α 1 положительно, целое число представляет собой сокращение n 1 .
Когда параметр ближнего порядка α 1 отрицателен, целое число представляет собой округление n 1 , поскольку атомы B имеют тенденцию к обогащению в ближайшей соседней оболочке из-за режима притяжения между центральный атом А и соседние атомы В. В качестве альтернативы, когда α 1 положительно, целое число представляет собой сокращение n 1 .
Примеры бинарных сплавов Cu
Сплав Cu-30Zn
 В соответствии с общей кластерной формулой бинарных ГЦК твердых растворов [A-M 12 ]A x B y , растворенный Zn расположен в центре кластера и ближайший к нему c 1 = 12 атомов, обогащенных в растворителе Cu, что приводит к кластерной формуле [Zn-Cu N 1 Zn 12- N 1 ] ZN x 1 ] ZN x 1 ] ZN x 1 ] ZN x 1 ]. Zn-M 12 ]Zn x Cu y , где M — усредненный атом ближайшего соседа.
В соответствии с общей кластерной формулой бинарных ГЦК твердых растворов [A-M 12 ]A x B y , растворенный Zn расположен в центре кластера и ближайший к нему c 1 = 12 атомов, обогащенных в растворителе Cu, что приводит к кластерной формуле [Zn-Cu N 1 Zn 12- N 1 ] ZN x 1 ] ZN x 1 ] ZN x 1 ] ZN x 1 ]. Zn-M 12 ]Zn x Cu y , где M — усредненный атом ближайшего соседа. The Goldschmidt atomic radii 19 are R Zn = 1.39 Å and R Cu = 1.28 Å, R M = (10 R Cu + 2 R Zn )/12 = 1,30 Å, так что R A/M = 1,39/1,30 = 1,07 и R B/M =9,8 1,01,28/1,28/1,28/1,07 В сочетании с составом сплава M B = (10+ Y )/(13+ x + Y ) = 0,689, уникальное ( x , Y ) решение (2.3, 1.8). Близкие целые числа — это (2, 2) и (3, 1). The corrosponding chemical units are then [Zn-Cu 10 Zn 2 ]Zn 2 Cu 2 = Cu 12 Zn 5 = Cu 70.59 Zn 29.41 = Cu-30.01Zn ( мас.%) и [Zn-Cu 10 Zn 2 ]Zn 3 Cu 1 = Cu 11 Zn 6 = Cu 64,71 Zn 35,29 = Cu-35,96Zn. Состав сплава Cu 68,9 Zn 31,1 как раз находится между двумя составами химических единиц.
The Goldschmidt atomic radii 19 are R Zn = 1.39 Å and R Cu = 1.28 Å, R M = (10 R Cu + 2 R Zn )/12 = 1,30 Å, так что R A/M = 1,39/1,30 = 1,07 и R B/M =9,8 1,01,28/1,28/1,28/1,07 В сочетании с составом сплава M B = (10+ Y )/(13+ x + Y ) = 0,689, уникальное ( x , Y ) решение (2.3, 1.8). Близкие целые числа — это (2, 2) и (3, 1). The corrosponding chemical units are then [Zn-Cu 10 Zn 2 ]Zn 2 Cu 2 = Cu 12 Zn 5 = Cu 70.59 Zn 29.41 = Cu-30.01Zn ( мас.%) и [Zn-Cu 10 Zn 2 ]Zn 3 Cu 1 = Cu 11 Zn 6 = Cu 64,71 Zn 35,29 = Cu-35,96Zn. Состав сплава Cu 68,9 Zn 31,1 как раз находится между двумя составами химических единиц. Соответствующий массовый процент 64,04–69,99 мас.% Cu точно соответствует наиболее широко используемой патронной латуни C26000 (номинальное 70Cu–30Zn, с указанными диапазонами составов 68,5–71,5 Cu, 0,05 Fe макс., 0,07 Pb макс., 0,15 макс. другие (всего) , бал Zn) 20 .
Соответствующий массовый процент 64,04–69,99 мас.% Cu точно соответствует наиболее широко используемой патронной латуни C26000 (номинальное 70Cu–30Zn, с указанными диапазонами составов 68,5–71,5 Cu, 0,05 Fe макс., 0,07 Pb макс., 0,15 макс. другие (всего) , бал Zn) 20 . Cu-8Al алюминиевая бронза
 67 = = = = = = = = = = = = = = = = = = = = = = = = = = = = . 12 ]Al 1 Cu 4 = Cu 16 Al 2 = Cu 88,89 Al 11,8 4 Cu=,11,11 49034 Массовая доля атомов Al колеблется от 5,04 до 7,83, что объясняет наиболее популярный C61000 (92Cu-8Al с диапазоном составов 6,0–8,5 Al, 0,05 Fe не более, 0,02 Pb не более, 0,20 Zn не более, 0,10 Si не более, 0,50 не более Прочее (всего), бал. Cu) 20 .
67 = = = = = = = = = = = = = = = = = = = = = = = = = = = = . 12 ]Al 1 Cu 4 = Cu 16 Al 2 = Cu 88,89 Al 11,8 4 Cu=,11,11 49034 Массовая доля атомов Al колеблется от 5,04 до 7,83, что объясняет наиболее популярный C61000 (92Cu-8Al с диапазоном составов 6,0–8,5 Al, 0,05 Fe не более, 0,02 Pb не более, 0,20 Zn не более, 0,10 Si не более, 0,50 не более Прочее (всего), бал. Cu) 20 . CU-20NI-сплав
 54Ни. Диапазон от 17,57 до 23,54 атомов никеля объясняет сплав C71000 (80Cu-20Ni, заданные диапазоны: 19–23 Ni, 0,05 макс. Pb, 1,00 Fe, 1,0 макс. Zn, 1,00 Mn, 0,5 макс. другие (всего), bal Cu) , которые обычно используются в качестве конденсаторов, конденсаторных пластин и электрических пружин 20 .
54Ни. Диапазон от 17,57 до 23,54 атомов никеля объясняет сплав C71000 (80Cu-20Ni, заданные диапазоны: 19–23 Ni, 0,05 макс. Pb, 1,00 Fe, 1,0 макс. Zn, 1,00 Mn, 0,5 макс. другие (всего), bal Cu) , которые обычно используются в качестве конденсаторов, конденсаторных пластин и электрических пружин 20 . Cu-2Be бериллиевая бронза
 Этот диапазон объясняет сплав C17200 (от 1,8 до 2,0 Be, минимум 0,20 Ni + Co, максимум 0,6 Ni + Co + Fe, максимум 0,10 Pb, максимум 0,5 другого (всего), bal Cu), который является наиболее популярным сплавом Cu-Be для проявляя высокую прочность и эластичность 20 .
Этот диапазон объясняет сплав C17200 (от 1,8 до 2,0 Be, минимум 0,20 Ni + Co, максимум 0,6 Ni + Co + Fe, максимум 0,10 Pb, максимум 0,5 другого (всего), bal Cu), который является наиболее популярным сплавом Cu-Be для проявляя высокую прочность и эластичность 20 . 17,21,22,23,24,26 и модель кластер плюс атом клея.
17,21,22,23,24,26 и модель кластер плюс атом клея. 
Выводы
 . Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах.
. Эта работа отвечает на давний вопрос о происхождении состава промышленных сплавов на основе твердых растворов, прослеживая молекулярные химические единицы, участвующие в химическом ближнем упорядочении в твердых растворах. Доступность данных
Ссылки
 Дж. Влияние термического перемешивания на расположение атомов в сплавах. Проц. Р. Соц. Лонд. А 145 , 699–730 (1934).
Дж. Влияние термического перемешивания на расположение атомов в сплавах. Проц. Р. Соц. Лонд. А 145 , 699–730 (1934).

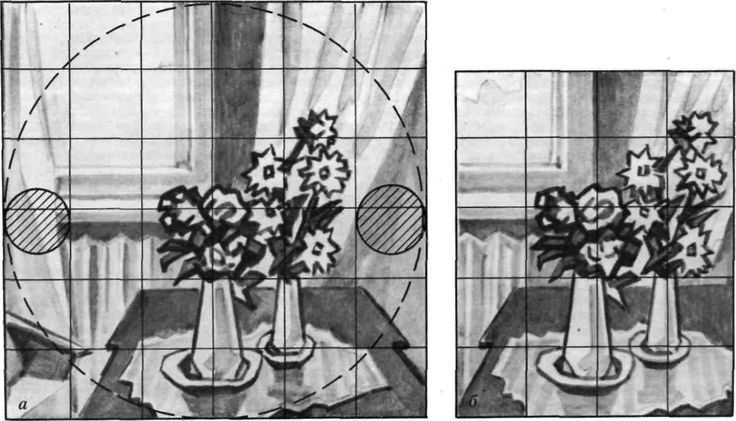 Нац. вычисл. науч. 1 , 54–61 (2021).
Нац. вычисл. науч. 1 , 54–61 (2021). Благодарности
Информация об авторе
Авторы и организации
Contributions
 L. провел основные расчеты и проанализировал данные сплава. Д.Д. и К.Д. предложил теорию. С.З., К.В. и Л.З. проверил интерпретацию сплава. В написании статьи участвовали все авторы.
L. провел основные расчеты и проанализировал данные сплава. Д.Д. и К.Д. предложил теорию. С.З., К.В. и Л.З. проверил интерпретацию сплава. В написании статьи участвовали все авторы. Автор, ответственный за переписку
Декларации этики
Конкурирующие интересы
Дополнительная информация
Примечание издателя
Права и разрешения
 Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/. Об этой статье
Комментарии
Состав поверхности растворов аминокислот и галоидных солей зависит от рН
Науки об окружающей среде: атмосферы
Состав поверхности растворов аминокислот и галогенидных солей зависит от pH†
Гитанджали Гопакумар, ‡ и Исаак Унгер, ‡* и Клара-Магдалена Саак, аб Гуннар Орвалл, c Арнальдо Навес-де-Брито, d Тулио Коста Ризути да Роша, и Кристоф Николя, ф Карл Калеман * аг а также Олле Бьорнехольм* a
Принадлежности автора
* Соответствующие авторы
и Кафедра физики и астрономии, Уппсальский университет, Box 516, SE-75120, Уппсала, Швеция
Электронная почта: isaak. [email protected], [email protected], [email protected]
[email protected], [email protected], [email protected]
б Венский университет, кафедра физической химии, Верингерштрассе 42, 1090 Вена, Австрия
с Лаборатория MAX IV, Лундский университет, а/я 118, SE-22100 Лунд, Швеция
д Кампинасский университет, Rua Sergio Buarque de Holanda, 777, Cidade Universitária, 13083-970 Кампинас, СП, Бразилия
и Бразильская лаборатория синхротронного света (LNLS), Бразильский центр исследований энергии и материалов (CNPEM), 13083-970 Кампинас, Сан-Паулу, Бразилия
ф Synchrotron SOLEIL, L’Orme des Merisiers, Saint-Aubin – BP 48, Gif-sur-Yvette, Франция
г Центр изучения лазеров на свободных электронах, DESY, Notkestrasse 85, DE-22607 Гамбург, Германия
Аннотация
rsc.org/schema/rscart38″> В частицах атмосферного аэрозоля химический состав поверхности определяет как гетерогенные химические реакции с газофазными частицами, так и способность действовать как ядра для облачных капель. Ожидается, что pH в аэрозольных частицах будет влиять на эти свойства, но измерить pH в отдельных каплях очень сложно, что не позволяет исследовать его влияние на состав поверхности частиц. В этой работе мы используем фотоэлектронную спектроскопию, чтобы исследовать, как состав поверхности водных растворов, содержащих неорганические соли и аминокислоты, изменяется в зависимости от рН. Наблюдается изменение в 4–5 раз относительного распределения неорганических ионов на поверхности жидкой струи воды в зависимости от рН раствора и типа аминокислоты в растворе. Движущими силами для улучшения или истощения поверхности являются ионное спаривание и образование заряженных слоев вблизи водной поверхности. Варианты загрузки Пожалуйста, подождите. ..
..
Дополнительные файлы
- Дополнительная информация PDF (324 КБ)
Прозрачное рецензирование
Для обеспечения большей прозрачности мы предлагаем авторам возможность публиковать историю рецензирования вместе со своей статьей.
Посмотреть историю рецензирования этой статьи
Информация о товаре
- ДОИ
- https://doi.org/10.1039/D1EA00104C
- Тип изделия
- Бумага
- Отправлено
- 20 декабря 2021 г.
- Принято
- 02 мар 2022
- Впервые опубликовано
- 08 марта 2022
- Эта статья находится в открытом доступе
Скачать цитату
Окружающая среда. наук: Атмосфер. , 2022 , 2 , 441-448
наук: Атмосфер. , 2022 , 2 , 441-448
BibTexEndNoteMEDLINEProCiteReferenceManagerRefWorksRIS
Разрешения
Запросить разрешения
Общественная деятельность
Поиск статей по автору
Гитанджали Гопакумар
Исаак Унгер
Клара-Магдалена Саак
Гуннар Эрвалл
Арнальдо Навес де Брито
Тулио Коста Ризути да Роша
Кристоф Николя
Карл Калеман
Олле Бьорнехольм
Получение данных из CrossRef.
г.
Загрузка может занять некоторое время.
Прожектор
Объявления
Растворы и концентрирование. Состав раствора
Химические реакции часто протекают место в водных растворах. Для выполнения стехиометрических расчеты в таких случаях количества химических веществ, присутствующих в растворе — концентрация раствора — должен быть известен.
Концентрация раствора измерение, устанавливающее количество растворенного вещества, присутствующего в известном количестве раствор:
Концентрация = количество растворенного вещества / количество раствор
Термины растворенное вещество и раствор обычно используются для жидких проб, но их можно расширить и для газообразных и твердых образцы.
Наиболее распространенные единицы
концентрации приведены в таблице I. 1:
1:
Общие единицы Концентрация | ||
Имя | Символ | Единицы |
молярность | моль растворенного вещества / литр решение | М |
моляльность | моль растворенного вещества/кг растворитель | м |
нормальность | номер эквивалента вес растворенного вещества / литров раствора | Н |
официальность | количество формальных весов растворенного вещества / литров раствора | Ф |
вес. | г растворенного вещества / 100 г решение | % вес/вес |
объемный % | мл растворенного вещества / 100 мл решение | % в/в |
масса к объему % | г растворенного вещества / 100 мл решение | % ж/об |
частей на миллион | г растворенного вещества / 10 6 г раствор | частей на миллион |
частей на миллиард | г растворенного вещества / 10 9 г раствор | частей на миллиард |
Примечание. Другой способ описания
концентрация раствора моль
дробь (xi)
Другой способ описания
концентрация раствора моль
дробь (xi)
Молярность (M) определяется как количество молей растворенного вещества на литр решение.
т.е. путем растворения 0,1 моль NaOH в 1 л H 2 O дает раствор, содержащий 0,1 моль Na + и 0,1 моль ОН — в 1 л. Концентрация раствора [Na + ] = 0,1 М и [OH — ] = 0,1 М.
Поскольку молярность зависит от объем раствора незначительно изменяется с температурой.
Другой способ описания решения концентрация моляльность (m) – количество молей растворенного вещества на килограмм растворитель.
Моляльность не зависит от температуры, так как зависит от масса.
В очень разбавленных водных растворах молярность (M) и моляльность (m) почти одинаковы.
Пример #1
Раствор 1М
H 2 SO 4 имеет плотность 1,04 г/см 3 . Рассчитать
(% мас./мас.) концентрация раствора.
Рассчитать
(% мас./мас.) концентрация раствора.
Дано | [H 2 SO 4 ] = 1M д = 1,04 г/см 3 P h3O = 41 мм рт.ст. МВт h3SO4 = 98 г/моль |
Спросил для | (масс.%) = ? |
Из определения (% вес/вес) = г растворенного вещества / 100 г раствора (1)
Масса растворенного вещества (г растворенного вещества)
неизвестен, но его можно вычислить.
Поскольку [H 2 SO 4 ] = 1M ⇒ 1000 см 3 из H 2 SO 4 раствор содержит 1 моль «чистого» H 2 SO 4 (2)
Масса 1 моля «чистый» Н 2 SO 4 можно рассчитать, как показано внизу:
масса (г) = моль * Молекулярная масса = 1 моль * 98 г/моль = 98 g (3)
Из (2) и d = m/V = 1,04 г/см 3 масса 1000 см 3 H 2 SO 4 можно рассчитать:
м = d * V = 1,04 г/см 3 * 1000 см 3 7 9 SO0347 4 раствор (4)
Из (2), (3) и (4):
Масса 1040 г H 2 SO 4 раствор содержит 98 г «чистого» H 2 SO 4
Масса 100 г раствора H 2 SO 4 содержать х = ? г «чистого» H 2 SO 4
x = 98 г «чистого» H 2 SO 4 * (100 г H 2 SO 4 г H0348 SO 4 ) = 9,42 г «чистого» H 2 SO 4
Следовательно, (вес. %) =
9.42
%) =
9.42
При условии, что теория и определение единиц концентрации раствора понимается как калькулятор % раствора может быть использован.
Предназначен для использования как в Учебно-научная лаборатория, % калькулятор решений можно использовать для выполнения ряд различных расчетов для приготовления процентных (%) растворов при начиная с твердого или жидкого материала.
Дополнительный пример решения
относительно растворов и концентрации показано в следующем видео
Соответствующие сообщения растворов — Закон Генри — Влияние давления на Растворимость
Ссылки
David W.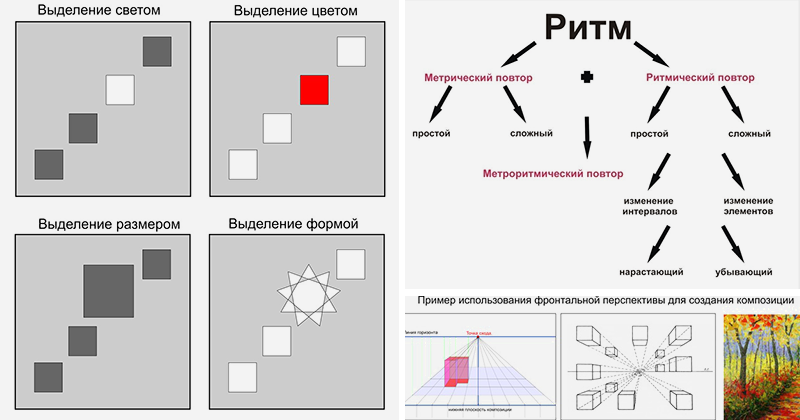 Oxtoby, H.P.
Гиллис, Алан Кэмпион, «Принципы современной химии», шестой
Издание, Томсон Брукс/Коул, 2008 г.
Oxtoby, H.P.
Гиллис, Алан Кэмпион, «Принципы современной химии», шестой
Издание, Томсон Брукс/Коул, 2008 г.
Стивен С. Зумдал, «Chemical Principles» 6 th Edition, Houghton Mifflin Company, 2009
Ральф Х. Петруччи, «Общая химия», 3 rd Edition, Macmillan Publishing Co., 1982
Ключевые термины
раствор, концентрация, состав, растворы, молярность M, моляльность m, нормальность N, формальность F, % мас./мас., %v/v, ppm, ppb, IB chemistry, Chemistry Net, как определить концентрацию раствора задачи, молярность концентрации раствора, единицы концентрации раствора, раствор определение концентрации, примеры концентрации раствора
Жидкие растворы
Литература для этого раздела
Петруччи: Глава 13 (разделы 1–6)
Введение
Растворы представляют собой гомогенные смеси более чем одного вещества. Слово
гомогенность означает, что смесь представляет собой единую фазу, свойства которой будут
быть одинаковым, где бы ни был взят образец.
Слово
гомогенность означает, что смесь представляет собой единую фазу, свойства которой будут
быть одинаковым, где бы ни был взят образец.
Мы можем подтвердить, что смесь более чем одного компонента является раствором, наиболее
раз, просто глядя на нашу смесь. Если мы сможем видеть сквозь смесь
(очистить) то скорее всего однофазный, значит раствор. Если
смесь непрозрачна, то вероятны две или более фаз, которые не смешиваются
друг с другом и, следовательно, рассеивают свет, делая его облачным. Таким образом,
яблочный сок — это раствор, тогда как в молоке есть вода, капли масла и немного молока
твердые вещества, находящиеся во взвешенном состоянии, но не растворяющиеся друг в друге. Мы можем увидеть
лучше, если мы оставим негомогонизированное молоко на некоторое время. Крем (масла) будет
подняться наверх, оставив более прозрачную жидкость (в основном воду с небольшим количеством
взвешенные вещества, называемые пахтой) ниже. При дальнейшем физическом
обработки (например, центрифуги), мы можем разделить компоненты молока даже
дальше. Ясно, что смесь, которую мы видели как «молоко», не была решением, хотя
могли быть некоторые его компоненты, которые были (например, более одного типа
масло, растворенное друг в друге, чтобы масло стало частью крема.
Ясно, что смесь, которую мы видели как «молоко», не была решением, хотя
могли быть некоторые его компоненты, которые были (например, более одного типа
масло, растворенное друг в друге, чтобы масло стало частью крема.
Когда вы проводите наблюдения за жидкими смесями в лаборатории, важно поэтому для обозначения цвета (красный, синий, розовый…), а также прозрачности (прозрачный, непрозрачный, мутный, молочный…) жидкого образца, который вы описываете. Таким образом, яблочный сок представляет собой прозрачный и желтый раствор, тогда как молоко представляет собой непрозрачный, непрозрачный раствор. белая смесь. Наблюдение ясности позволяет с уверенностью сказать что яблочный сок представляет собой одну фазу и, следовательно, раствор, тогда как молоко не является одной фазой и, следовательно, это не единственный раствор.
Растворы могут быть твердыми, жидкими или газообразными (наиболее интересны жидкие растворы). к химикам).
Газовая фаза
Газофазные растворы легко образуются из любой смеси
газы, так как молекулы газа так редко взаимодействуют друг с другом. Если
смесь газов фактически не вступает в реакцию, то раствор в газовой фазе будет
почти наверняка образуется (по крайней мере, при комнатной температуре и давлении)
Если
смесь газов фактически не вступает в реакцию, то раствор в газовой фазе будет
почти наверняка образуется (по крайней мере, при комнатной температуре и давлении)
Жидкая фаза
В жидкой фазе молекулы расположены достаточно близко, чтобы межмолекулярные силы становятся важными. На этом этапе решение будет только образуются между (скажем) двумя видами А и В, если А—А, В—В и А-В межмолекулярные силы примерно одинаковы.
Например, гексан и гептан являются двумя неполярными жидкости. Межмолекулярные силы в каждой из этих чистых жидкостей равны в первую очередь дисперсионные силы из-за временных диполей. Это довольно слабые силы. Однако межмолекулярные силы, которые могли бы существовать между гексаном и гептаном также будет преимущественно дисперсионный характер. Следовательно, будет образовываться жидкий раствор. Говорят, что две жидкости полностью смешиваемый друг в друге.
Если силы одной из молекул для себе подобных
значительно большее, чем для другого, решение может и не образоваться. Возьмем, например,
Вода и гексан. Вода представляет собой полярную молекулу и, кроме того, она связывается с другими
молекулы воды с водородными связями. Это два сильнейших (и сильнейших) из
межмолекулярные силы (по сравнению с дисперсионными силами). Гексан, на
другая рука не может участвовать ни в одном из этих двух типов взаимодействия
и поэтому не будет смешиваться с водой. Эти две жидкости называются
несмешиваемый
друг в друге.
Возьмем, например,
Вода и гексан. Вода представляет собой полярную молекулу и, кроме того, она связывается с другими
молекулы воды с водородными связями. Это два сильнейших (и сильнейших) из
межмолекулярные силы (по сравнению с дисперсионными силами). Гексан, на
другая рука не может участвовать ни в одном из этих двух типов взаимодействия
и поэтому не будет смешиваться с водой. Эти две жидкости называются
несмешиваемый
друг в друге.
Твердая фаза (кристаллы)
В твердой фазе действуют не только межмолекулярные силы очень четко определены, но твердые кристаллы образуют жесткое расположение атомов расстояние между которыми достаточно регулярно. Чтобы подошёл второй тип молекулы, он должен быть того же размера и формы, что и молекулы-хозяева (или атомы).
Common Твердые «решения» этого типа можно найти в драгоценных камнях камней и металлических сплавов, среди прочего.
Молярность
Существует несколько распространенных методов сообщения о составе
решения, с которыми мы имеем дело. Конкретный метод, который мы используем
во многом зависит от того, как мы будем его использовать. В большинстве относительно
разбавлять растворы там, где нам нужны быстрые и простые расчеты, связывающие
число молей в растворе к объему, используем
молярность. Концентрация, в
Молярность можно рассчитать как:
Конкретный метод, который мы используем
во многом зависит от того, как мы будем его использовать. В большинстве относительно
разбавлять растворы там, где нам нужны быстрые и простые расчеты, связывающие
число молей в растворе к объему, используем
молярность. Концентрация, в
Молярность можно рассчитать как:
\[C_M\;=\;\frac{n}{V}\]
, где n = = количество молей растворенного вещества и V = объем
решение. Это дает нам концентрацию в единицах:
M ≡
моль литров -1 или моль л -1 .
Будьте осторожны
с уравнениями. Студенты часто путают переменные символы, используемые в уравнениях.
с символами единиц, используемыми в расчетах. Это пример.
Уравнение здесь не имеет буквы M в качестве переменной. Верхний регистр М используется в качестве переменной в другом месте для представления молярной массы, поэтому ее не следует использовать в
это уравнение для представления концентрации. Используется переменная C для представления концентрации любых единиц, и здесь C M стоит
для концентрации в молярности. Условное обозначение шт. шт.
концентрация называется молярность выделена курсивом в верхнем регистре M , который мы используем как ярлык для полностью выписанных единиц моль растворенного вещества на литр раствора (или просто моль/л),
Используется переменная C для представления концентрации любых единиц, и здесь C M стоит
для концентрации в молярности. Условное обозначение шт. шт.
концентрация называется молярность выделена курсивом в верхнем регистре M , который мы используем как ярлык для полностью выписанных единиц моль растворенного вещества на литр раствора (или просто моль/л),
Например:
Образец 0,243 моля сухого порошкообразного соединения растворяется в 1,45 л жидкого растворителя. Какова молярная концентрация раствора?
Мы можем использовать приведенное выше уравнение, чтобы решить это с одним
предостережение. Объем в уравнении предполагается равным литров.
раствор , но объем, указанный в этом примере, составляет литров
растворитель . Мы не можем просто использовать один том вместо другого в качестве
главное правило. Однако в этом случае мы добавляем небольшое количество
соединение с большим объемом жидкости, поэтому, хотя объем жидкости должен иметь
изменилось, не сильно изменилось. Если мы сделаем предположение, что
изменение незначительно, т.е. , объем раствора равен
объем растворителя, то мы можем продолжить.
Если мы сделаем предположение, что
изменение незначительно, т.е. , объем раствора равен
объем растворителя, то мы можем продолжить.
\[C_M\;=\;\frac{n}{V}\]
\[C_M\;=\;\frac{0,243 моль}{1,45 л}\;=\; 0,168 М\]
В качестве альтернативы (мое предпочтение) мы могли бы просто выяснить, как сделать это с помощью размерного анализа. Поскольку мы знаем конечные единицы концентрация, которую мы хотим, это моли на литр, мы просто делим количество моль растворенного вещества на объем раствора в литрах и вуаля! тот же ответ без уравнения для запоминания.
Единственным недостатком использования молярности является то, что объем растворителя не
обязательно объем раствора и, следовательно, мы должны измерить количество
растворенного вещества перед смешиванием, но измерьте объем раствора после смешивания, а затем
рассчитать. Молярные концентрации очень полезны для экспериментов, где
делаем объемные замеры. Титрование является ярким примером
эксперимент, в котором молярность является наиболее удобной единицей измерения. В
титрования, мы измеряем объем раствора, добавленного из бюретки, и можем быстро
подсчитайте количество добавленных молей.
В
титрования, мы измеряем объем раствора, добавленного из бюретки, и можем быстро
подсчитайте количество добавленных молей.
\[n\;=\;C_M\times V\]
В заключение повторю: используйте размерный анализ, чтобы выяснить, как сделать это, а не запоминать эти уравнения. Как только вы поймете фактические номера, которые вам нужно использовать для n и для V , вам не нужны уравнение больше.
Моляльность
В некоторых случаях нелегко измерить объемы растворов после смешивания или
возможно, это просто не важно. В таких случаях молярность не может быть
полезная единица, установленная для использования. Альтернативная единица измерения концентрации
моляльность. Моляльность не является
объемная единица и не будет полезна в ситуациях, когда нам нужно измерить
объемы жидких растворов. Тем не менее, это очень полезно в ситуациях
где нам просто нужно создать растворы известных концентраций.
единицы моляльности молей растворенного вещества на килограмм растворителя . Мы
используйте сокращение выделенного курсивом нижнего регистра m для моляля. Этот набор
единиц означает, что мы можем быстро измерить гравиметрически как растворенное, так и
растворителя, смешать их вместе и получить раствор с легко вычисляемой
концентрация в единицах моляльности.
Мы
используйте сокращение выделенного курсивом нижнего регистра m для моляля. Этот набор
единиц означает, что мы можем быстро измерить гравиметрически как растворенное, так и
растворителя, смешать их вместе и получить раствор с легко вычисляемой
концентрация в единицах моляльности.
\[C_m\;=\;\frac{n}{m}\]
Здесь C m — переменная, представляющая концентрацию в моляльности (нижний регистр m ) n – моли растворенного вещества, как это было в определении молярность и переменная m — это масса растворителя (в кг) .
Обратите внимание, что буква m используется здесь двояко. Как
переменная, m представляет собой массу растворителя в кг, но как
ед., м является символом моляльности. Единица, связанная с переменной концентрации C m м , который
представляет собой ярлык, представляющий молей растворенного вещества на килограмм растворенного вещества (или просто моль/кг).
Пример:
Какова молярная концентрация раствора, полученного при добавлении 0,213 г щавелевой кислоты кислота (COOH) 2 на 1200 г воды?
Нам нужно уравнение:
\[C_m\;=\;\frac{n}{m}\]
Щавелевая кислота. Мы можем использовать молярную массу щавелевой кислоты, чтобы преобразовать g в молей щавелевой кислоты.
\[n\;=\;0,213 г \left|\frac{1\, моль}{90,035 g}\right|\;=\;0,00237 моль\]
Теперь мы можем рассчитать концентрацию раствора
\[C_m\;=\;\frac{0,00237 моль}{1,2 кг}\;=\ ;0,00197 м\]
Молярная доля
Такие шкалы, как молярность и моляльность, полезны только в случае относительно разбавленные растворы, в которых один из видов явно является наиболее распространенным (называемым растворитель), а другой находится в относительно небольших пропорциях (растворенное вещество). Самый диапазон концентраций растворов недоступен с использованием этого типа терминология. что, если у нас есть раствор, состоящий из равного количества молей A и Б? Какое растворенное вещество? Какой растворитель?
Измерение, которое работает для любого диапазона концентраций и не требует растворенного вещества/растворителя
различие заключается в мольной доле $\chi$, когда речь идет о растворах, образующихся в течение
широкий диапазон концентраций. Для этой переменной концентрации мы используем греческий
буква chi ($\chi$, а не заглавная X), что эквивалентно нашей букве C.
Однако мы часто не делаем различий
Для этой переменной концентрации мы используем греческий
буква chi ($\chi$, а не заглавная X), что эквивалентно нашей букве C.
Однако мы часто не делаем различий
Мольная доля компонента (i) в смеси нескольких компонентов (I количество компонентов) определяется как 9I \chi_i\;=\;1$ .
Вернуться к началу
В идеальном растворе двух компонентов А и В межмолекулярные силы между молекулами A—A, B—B и A—B все идентичны. На самом деле мы этого никогда не произойдет, но мы можем найти решения, в которых силы очень велики. близко к равному. Одним из примеров смеси, которая образует почти идеальные растворы, является гексан и гептан. Эти два углеводорода с «прямой цепью» имеют схожие свойства. молекулярная масса (имеют длину шесть и семь атомов углерода соответственно). Они оба неполярны и, следовательно, могут взаимодействовать только с использованием дисперсионного типа. межмолекулярные силы.
Рассмотрим смесь гексана (А) и гептана (В). Поскольку обе эти жидкости
являются летучими, мы ожидаем, что раствор тоже будет иметь давление паров. пар будет состоять из смеси двух газов. Суммарное давление этого
смесь, согласно закону Дальтона:
пар будет состоять из смеси двух газов. Суммарное давление этого
смесь, согласно закону Дальтона:
P * Soln = p A + p B {сумма парциальных давлений}
Для идеальных растворов мы можем определить составляющую парциального давления в пара, находящегося в равновесии с раствором, в зависимости от мольной доли жидкость в растворе. Это закон Рауля:
p A = x A P* A а также р В = х В Р* В
Подставляя в первое уравнение, получаем
P * Soln = x A P* A + x Б П* Б или
P * Soln = x A P* А + ( 1-x A ) P* B
знак равно P* B + x A ( P* A — Р* Б )
Из этого соотношения мы видим, что давление паров раствора A
и B является линейной функцией мольной доли A (или B), где P* B — точка пересечения и П* А — П* В это наклон.
Пар, собирающийся над раствором, будет иметь состав,
не обязательно такой же, как у жидкости. Более летучий компонент
легче испаряется и поэтому будет иметь более высокую молярную долю в паровой фазе
чем в жидкой фазе.
Мы можем написать
Молярная доля А в паровой фазе = y A
Мольная доля B в паровой фазе = y B
Мы можем рассчитать эти значения по концентрациям растворов, используя Закон Даултона выглядит следующим образом.
Кривая состава пара может быть построена, как показано на
рисунок ниже. На самом деле это два графика, один из которых (прямая линия) является
Давление паров раствора по сравнению с составом жидкости x A и другой (изогнутая линия) — одно и то же Давление паров
раствора, но нанесенный на график в зависимости от состава пара у А . Это можно представить как подтягивание линии жидкости к
вправо (в сторону более летучей жидкости А). Горизонтальный связующие линии соединяют две кривые таким образом, что для любого заданного давления паров
жидкий состав х А и соответствующий состав пара y A может быть
определяется, как показано стрелками на рисунках.
Горизонтальный связующие линии соединяют две кривые таким образом, что для любого заданного давления паров
жидкий состав х А и соответствующий состав пара y A может быть
определяется, как показано стрелками на рисунках.
Обычно мы не проводим эксперименты с постоянной температурой, как кажется
быть указано на двух предыдущих рисунках и соответствующем обсуждении. Сделать
поэтому потребуются сложные устройства для измерения давления, герметичные жесткие контейнеры.
и устройства постоянной температуры. Мы можем гораздо проще провести измерение
температуры при фиксированном давлении (скажем, один бар) в зависимости от мольной доли.
Таким образом, мы получили бы график зависимости температуры кипения раствора от молярной массы.
часть раствора. К этому мы можем добавить график пара
сочинение. Эту кривую можно рассчитать, используя концепции, очень похожие на те, что
обсуждалось выше для случая постоянной температуры. Получившаяся кривая (см.
ниже) смещается в сторону более высокой составляющей давления пара, как это было в
диаграмма выше.
Получившаяся кривая (см.
ниже) смещается в сторону более высокой составляющей давления пара, как это было в
диаграмма выше.
В этом случае, поскольку мы уже знаем, что давление пара не является линейной функции температуры ( ср. уравнение Клаузиуса-Клапейрона), мы не ожидайте прямой график температуры кипения в зависимости от состава. Однако для идеального решения кривизна линии незначительна.
Давайте более подробно рассмотрим завязку. График «Т против моль фракция A» выше содержит три области.
- Над кривыми показана одна фаза. При любой температуре и моль фракционное состояние, все компоненты находятся в паровой фазе.
- Под кривой находится одна фаза. При любой температуре и моль фракционное состояние ниже кривых, все компоненты находятся в жидкой фазе.
- Любая ситуация температуры/состава между двумя линиями, есть
две фазы, находящиеся в равновесии друг с другом. Одна представляет собой газовую фазу с
мольные доли компонентов г я .
 Другой — жидкость
фаза с мольными долями компонентов x i .
Другой — жидкость
фаза с мольными долями компонентов x i .
Для любой экспериментальной установки, имеющей точку температуры/состава, находится между двумя фазами, мы можем рассчитать относительные количества (общая количество молей) двух фаз с использованием относительных длин связующей линии отрезки по обе стороны от точки. На приведенной ниже диаграмме увеличен область привязки предыдущего рисунка; синяя линия представляет жидкость состав раствора, зеленая линия – состав пара. по вертикальной оси отложена температура, а по горизонтальной оси отложена молярная доля компонент А в двухкомпонентной смеси А и Б. Вертикальный фиолетовый линия представляет общую молярную долю системы (как жидкости, так и пара фаза). Вертикальное положение связующей линии представляет собой температура системы.
В соответствии с правилом рычага (которое впервые было разработано для реальных рычагов, но
работает и здесь), длина сегмента, умноженная на количество молей
отрезок одной стороны равен произведению длины на количество молей другой стороны.
N 1 × L 1 = N 2 × L 2
9на задний ход. п 1 в моли пара n 2 с использованием длины L 1 и L 2 следующим образом:
\[\frac{n_1}{n_2}\;=\;\frac{L_2}{L_1}\]
Это имеет смысл, если мы посмотрим на график. Если L 1 есть короче чем L 2 (как показано на рисунке), то общий состав система ближе к жидкой, чем к паровой фазе. Это означает, что большая часть молей материала находится в жидкой фазе.
Пример: закрытая система, содержащая две летучие смешивающиеся жидкости A и B позволяет достичь равновесия. Общее число молей системы составляет 1,32 моля. При равновесии в паре находится 0,36 моля. фаза. Каково отношение длин отрезков L 1 и л 2 на диаграмме связующей линии, как показано на рисунке выше?
моль жидкости ( n 1 ) = общее количество молей ( н Т ) — моль пара ( n 2 )
n 1 = 1,32 моль —
0,36 моль = 0,96 моль.
\[\frac{n_1}{n_2}\;=\;\frac{L_2}{L_1}\]
\[\frac{0,96}{0,36}\;=\;\frac{L2}{ L_1}\;=\;2.66\]
Таким образом, отношение длин двух отрезков будет равно 2,66. Или L 2 в 2,66 раза длиннее, чем L 1 .
Наверх
Если бы мы собрали весь пар над жидкостью при температуре кипения а затем сконденсировать его, мы бы получили жидкость, которая была выше в более летучих компонент, чем исходный материал. Если мы затем снова вскипятим эту жидкость, мы снова увеличить содержание более летучего компонента в полученном дистилляте. С повторяющиеся шаги кипения, конденсации, снова кипения, мы можем в конце концов полностью разделить два компонента. Это потребует, однако, бесконечное количество шагов.
Вернуться к началу
Азеотропы
Более сложная ситуация в случае двух жидкостей, A и B,
которые полностью смешиваются, но силы межмолекулярных сил различаются
существенно. Есть две возможности:
Есть две возможности:
- Средние межмолекулярные силы в растворе сильнее, чем в индивидуальные жидкости
- Средние межмолекулярные силы в растворе слабее, чем в отдельные жидкости.
Поскольку межмолекулярные силы, удерживающие жидкость вместе, определяют давление пара (и, следовательно, температуру кипения жидкости), мы можем предсказать, что в первом случае (1) ожидаемая температура кипения раствора должна быть выше, чем у любой чистой жидкости, в то время как в последнем случае (2) раствор будет кипеть при более низкой температуре, чем точка кипения любого из две чистые жидкости.
Рассмотрим раствор бензола и этанола. Бензол и этанол являются
полностью смешивается, но межмолекулярные силы в растворе меньше, чем
в отдельных жидкостях. Поскольку силы, удерживающие молекулы, меньше,
энергия (температура), необходимая для разрушения этих сил, меньше. Таким образом, мы
ожидать, что на кривой температуры кипения будет минимум (см. рис. ниже). при минимальной температуре кипения раствора (мольная доля этанола =
0.46) также находим, что состав пара идентичен составу
жидкость. это называется азеотропная смесь и особенно
Точка на кривой температуры кипения называется
азеотроп.
ниже). при минимальной температуре кипения раствора (мольная доля этанола =
0.46) также находим, что состав пара идентичен составу
жидкость. это называется азеотропная смесь и особенно
Точка на кривой температуры кипения называется
азеотроп.
Максимальное кипение азеотропа происходит, когда межмолекулярное силы смеси больше, чем силы отдельных жидкостей. Это приводит к смесь с более высокой температурой кипения (более низким давлением паров), чем индивидуальный. В этом случае пар, находящийся в равновесии с жидкостью, имеет составов от состава азеотропной смеси к чистой жидкости.
Вернуться к началу
Если вы достаточно охладите раствор, он замерзнет. Разрешение
чтобы замерзание происходило достаточно медленно и твердое вещество, которое кристаллизуется,
будет чистым. Температура начала замерзания раствора зависит от
состав раствора. Возьмем, к примеру, смесь уксусной кислоты и
вода. Чистая вода замерзает при 0°С, а чистая уксусная кислота замерзает при +16,6°С. Для целей следующей иллюстрации я хочу пояснить
различие между словом состояние и словом фаза.
Для целей следующей иллюстрации я хочу пояснить
различие между словом состояние и словом фаза.
Состояние — это одно из трех состояний: твердое, жидкое или газообразное. Никакого различия не проводится в отношении материала в этом состоянии.
Фаза представляет собой состояние, при котором состав указан материал в этом состоянии.
На приведенной выше фазовой диаграмме показаны четыре различных области с цветовой кодировкой.
- Желтая область представляет собой однофазный жидкий раствор.
- Синяя область представляет однофазную, но двухфазную область, где лед и твердые кристаллы уксусной кислоты смешаны (может быть твердый раствор или может и нет, предположим, что нет).
- Красная область представляет собой двухуровневое равновесие между чистым твердым льдом и
раствор, где состав раствора для любой заданной температуры
представлен положением линии, которая отделяет красный цвет от желтого
области.

- Фиолетовая область представляет двухсостояние равновесия между чистым твердым уксусная кислота и раствор, состав которого (при любой заданной температуре) представлен положением линии, разделяющей фиолетовый и желтый области.
Место пересечения красно-желтой и фиолетово-желтой границ представляет эвтектическую точку . Это представляет собой самый низкий состав температуры плавления для этого раствора. Для уксусной кислоты, воды эта точка находится при температуре -26,7С. Ниже этой температуры любая смесь льда и уксусная кислота твердая.
Эту диаграмму можно использовать для объяснения нескольких явлений.
Предположим, что жидкий раствор с мольной долей уксусной кислоты = 0,1 является медленно охлаждают, начиная с комнатной температуры. Какие фазовые переходы произойдут по мере прохождения процесса охлаждения. Следуйте по вертикальной линии (обозначенной звездочка) в x = 0,1.
- Первый фазовый переход происходит при температуре, соответствующей
точка пересечения вертикальной линии с красной зоной.
 В этот
температуры из раствора начинает кристаллизоваться лед. Это удаляет
воды из раствора, делая его более концентрированным в уксусной кислоте. Следовательно,
температура замерзания снижается. Этот процесс продолжается до тех пор, пока температура
опускается так, что состав раствора соответствует красно-желтому
границы до точки эвтектики.
В этот
температуры из раствора начинает кристаллизоваться лед. Это удаляет
воды из раствора, делая его более концентрированным в уксусной кислоте. Следовательно,
температура замерзания снижается. Этот процесс продолжается до тех пор, пока температура
опускается так, что состав раствора соответствует красно-желтому
границы до точки эвтектики. - Ниже точки эвтектики кристаллизуется как лед, так и твердая уксусная кислота.
Мы используем эти свойства в нашем повседневном опыте, например, в
радиаторы автомобилей наносим смесью этиленгликоля и воды.
Правильные пропорции этих двух соединений могут дать раствор, который замерзает при
температуры до -50С. Даже если и замерзнет, то будет делать это медленно, опуская
точки замерзания, как это происходит, и создавая вязкую смесь, а не единую
твердая фаза. Таким образом, даже при экстремально низких температурах, таких как в
на севере Канады охлаждающая смесь радиатора будет течь через двигатель и
не подключить его.
Еще раз посмотрите на схему. Если мы сделаем эксперимент при 10°С (ниже температуры плавления чистой уксусной кислоты), в котором мы начните с чистой воды и медленно добавляйте кристаллы уксусной кислоты, мы можем проследить двигаться по синей пунктирной линии.
Сначала уксусная кислота растворяется в воде. Как доля
уксусной кислоты, мы достигаем точки, где пунктирная линия переходит в
фиолетовая область. За пурпурно-желтой каймой мы увидели бы кристаллы уксусной кислоты.
кислота сидит на дне стакана. Раствор будет насыщенным (при
равновесие) и независимо от того, сколько еще твердой уксусной кислоты мы добавим в химический стакан,
не будет никакого дальнейшего чистого увеличения количества, которое растворится. Однако,
если мы поднимем температуру до комнатной, мы увидим остатки уксусной кислоты.
кислота растворяется, когда мы возвращаемся в желтую область на фазовой диаграмме.
Следовательно, мы можем использовать диаграмму для определения растворимости (концентрации при
равновесие) уксусной кислоты в воде при любой конкретной температуре.
Все фазовые диаграммы такого типа имеют одинаковые характеристики. Чистые жидкости имеют характерные температуры плавления, а эвтектическая точка представляет собой самую низкую температура плавления состава раствора. Всегда одни и те же четыре регионов, и всегда мы можем объяснить процессы замерзания/растворения, используя эти диаграммы.
В органической химии мы часто используем свойства растворов, чтобы определить, должным образом выделили желаемое соединение. Например, в синтезе эксперименты, которые вы делаете в лаборатории, вы проверяете чистоту кристаллов, которые вы сделать, измерив их температуру плавления. Если ваши кристаллы плавятся при правильном температура при вполне определенной температуре, то ваши кристаллы, вероятно, близки до чистого. Если, с другой стороны, они плавятся в большом диапазоне температур или хорошо ниже правильной температуры плавления, вы можете быть уверены, что ваши кристаллы не очень чистый.
Вернуться к началу
Иногда компоненты, смешиваемые для получения растворов, плавятся. моменты очень разные. Возьмем, к примеру, смешивание воды и соли.
например KCl. Соль плавится при очень высокой температуре (770 С). Единственная часть
Фазовая диаграмма, которая представляет для нас интерес, представляет собой часть, показанную на рис.
рисунок выше. Видны те же четыре области, которые мы заметили на
фазовая диаграмма вода/уксусная кислота. Однако в данном случае мы рассматриваем только
относительно низкие концентрации KCl в воде.
моменты очень разные. Возьмем, к примеру, смешивание воды и соли.
например KCl. Соль плавится при очень высокой температуре (770 С). Единственная часть
Фазовая диаграмма, которая представляет для нас интерес, представляет собой часть, показанную на рис.
рисунок выше. Видны те же четыре области, которые мы заметили на
фазовая диаграмма вода/уксусная кислота. Однако в данном случае мы рассматриваем только
относительно низкие концентрации KCl в воде.
Давайте проследим (слева направо) по горизонтальной линии, представляющей комнату
температура. Когда мы добавляем соль в нашу воду, соль сначала растворяется. Соль будет
продолжают растворяться до тех пор, пока концентрация находится в желтой зоне.
В конце концов, соль больше не растворяется, а просто оседает на дно.
стакан. Концентрация раствора, находящегося в равновесии с твердым телом
соль представлена пересечением горизонтальной линии с
фиолетово-желтая граница. Это растворимость соли в мольных долях.
Обычно мы измеряем растворимость в молях растворенного вещества на литр раствора. Мы можем
легко преобразовать мольную долю, определенную здесь, в более распространенные единицы, такие как
молярность. Легко видеть, что при повышении температуры раствора
растворимость тоже повышается.
Мы можем
легко преобразовать мольную долю, определенную здесь, в более распространенные единицы, такие как
молярность. Легко видеть, что при повышении температуры раствора
растворимость тоже повышается.
Мы также можем видеть, что соль добавляется в воду, как и в В предыдущем случае температура плавления воды снижается. Поэтому добавление соли в лед на тротуарах и дорогах снижает температуру плавления и (надеюсь) лед тает. Во многих частях Канады, таких как Саскачеван, температура зимой часто значительно ниже точки, при которой соль может принести какую-либо пользу (~-20°C) и, следовательно, он редко используется там.
Вернуться к началу
Общий опыт говорит нам, что газы также растворяются в жидкостях. Например,
рыбы могут жить под водой, отделяя растворенный кислород от воды с помощью
их жабры. Если вода застаивается и содержание растворенного кислорода
снижается из-за отсутствия аэрации (смешивания с воздухом) многих видов рыб
не может жить в нем. Другие виды выработали специальные механизмы выживания.
иметь дело с низким уровнем кислорода… Но это уже другая история.
Другие виды выработали специальные механизмы выживания.
иметь дело с низким уровнем кислорода… Но это уже другая история.
Мы также видим эффект растворения газа в жидкости всякий раз, когда открываем газированный напиток. В напитке растворен углекислый газ, и в то время как банка (или бутылка) закрыта, давление газа над жидкостью равно равновесие с растворенным газовым раствором. Это, конечно же, давление паров CO 2 в растворе. Когда банка открыта, CO 2 , чей давление пара выше нормального давления окружающей среды, выбрасывается в атмосферу, и жидкость начинает пузыриться по мере того, как растворенный CO 2 пуски переходит обратно в газовую фазу. Если мы встряхнем банку, прежде чем открыть ее, давление CO 2 над жидкостью заметно приподнято, почему?
Из этой серии наблюдений видно, что количество растворенного газа в
жидкость зависит от двух вещей. Во-первых, парциальное давление
газа над жидкостью. Во-вторых, скорость растворения/эволюции
газ.
Мы будем рассматривать только первый вариант и предположим, что прошло достаточно времени, чтобы достичь равновесия.
Закон Генри математически выражает то, что мы видели экспериментально,
\[C\;=\;k\times P_{gas}\]
Где Pgas — парциальное давление газа, а C — его моляр концентрация. k — константа, зависящая как от растворителя, так и от растворенный. Он называется параметром закона Генри.
Вернуться к началу
Проф. Майкл Дж. Момбуркетт.
Авторское право © 1997
Отредактировано: 12 сентября 2017 г. Решения для учебников
General Science Solutions Решения для класса 8 Science Chapter 6 Composition Of Matter представлены здесь с простыми пошаговыми пояснениями. Эти решения для состава вещества чрезвычайно популярны среди учащихся 8-го класса. Все вопросы и ответы из Книги по общим научным решениям 8-го класса, глава 6, предоставляются здесь для вас бесплатно. Вам также понравится безрекламный опыт работы с решениями General Science Solutions от Meritnation. Все решения General Science Solutions для класса 8 Science подготовлены экспертами и на 100% точны.
Эти решения для состава вещества чрезвычайно популярны среди учащихся 8-го класса. Все вопросы и ответы из Книги по общим научным решениям 8-го класса, глава 6, предоставляются здесь для вас бесплатно. Вам также понравится безрекламный опыт работы с решениями General Science Solutions от Meritnation. Все решения General Science Solutions для класса 8 Science подготовлены экспертами и на 100% точны.
Страница № 47:
Вопрос 1:
Выберите подходящий вариант и перепишите следующие утверждения.
A. Межмолекулярная сила _______ в частицах твердого тела.
я. Минимум ii. Умеренная iii.максимальная iv.неопределенная.
B. Твердые тела сохраняют свой объем даже при внешнем давлении. Это свойство называется__________
i. пластичность ii. Несжимаемость iii. текучесть iv. эластичность
C. Вещество классифицируется на смеси типов, соединения и элементы по критерию ______________
г. состояния вещества ii Фазы веществ iii химические составы вещества iv все перечисленные
D. Вещество, состоящее из двух или более составляющих веществ, называется __________
Вещество, состоящее из двух или более составляющих веществ, называется __________
i. смесь ii. соединение iii. элемент iv. металлоид
E. Молоко является примером вещества, называемого __________
i. решение ii. гомогенная смесь iii гетерогенная смесь iv. суспензия
F. Вода, ртуть и бром похожи друг на друга, потому что три равны
г. жидкости ii. соединения iii. неметаллы iv. элементы.
G. Валентность углерода равна 4, а кислорода равна 2. Из этого мы понимаем, что существует _______ химическая связь/связи между атомом углерода и одним атомом кислорода в соединении-углекислом газе.
я. 1 ii. 2 iii. 3 iv. 4
Ответ:
A. Межмолекулярная сила , максимальная в твердых частицах.
я. Минимум ii. Умеренная iii.максимальная iv.неопределенная.
B. Твердые тела сохраняют свой объем даже при внешнем давлении. Это свойство называется несжимаемостью .
я. пластичность ii. Несжимаемость iii. текучесть iv. эластичность
Несжимаемость iii. текучесть iv. эластичность
C. Вещество классифицируется на смеси типов, соединения и элементы с применением критерия состояний вещества .
я. состояния вещества ii Фазы веществ iii химические составы вещества iv все перечисленные
D. Вещество, состоящее из двух или более составляющих веществ, называется соединение .
я. смесь ii. соединение iii. элемент iv. металлоид
E. Молоко является примером вещества, называемого гомогенной смесью.
я. решение ii. гомогенная смесь iii гетерогенная смесь iv. суспензия
F. Вода, ртуть и бром похожи друг на друга, потому что три жидкости .
я. жидкости ii. соединения iii. неметаллы iv. элементы.
Г. валентность углерода 4, а кислорода 2. Отсюда мы понимаем, что существует 2 химическая связь/связи между атомом углерода и одним атомом кислорода в соединении двуокиси углерода.
я. 1 ii. 2 iii. 3 iv. 4
2 iii. 3 iv. 4
Страница № 47:
Вопрос 2:
Найдите лишнее и объясните
A. Золото, серебро, медь, латунь
B. Водород, перекись водорода, двуокись углерода, водяной пар.
C.Молоко, лимонный сок, углерод, сталь.
D.вода, ртуть, бром, бензин.
E.сахар, планка, пищевая сода, синий витрол.
F. Водород, натрий, калий, углерод.
Ответ:
а. Латунь является странным, потому что это сплав, а золото, серебро, медь являются элементами.
b.Водород является нечетным, потому что это элемент, а другие являются составными.
c.Углерод является нечетным, потому что это элемент, а другие представляют собой смесь различных элементов.
d.Вода является лишним, потому что она является универсальным растворителем, а остальные не являются универсальным растворителем.
е. Пищевая сода является необычной, потому что она представляет собой смесь различных элементов, а другие являются составными.
f.Углерод нечетный, потому что он имеет 4 валентных электрона, а другие имеют 1 валентный электрон.
Страница № 47:
Вопрос 3:
Ответьте на следующие вопросы.
А. Растения синтезируют глюкозу на солнце с помощью хлорофилла из углекислого газа и воды и отдают кислород. определите четыре соединения в этом процессе и назовите их типы.
B. В одном образце латуни были обнаружены следующие ингредиенты: медь (70%) и цинк (30%). Определите из них растворитель, растворенное вещество и раствор.
C. Морская вода имеет соленый вкус из-за растворенной соли. минерализация (доля солей в воде) некоторых водоемов озера Лонар — 7,9%, Тихий океан 3,5 %, Средиземное море- 3,8 %, Мертвое море- 33,7 %. Объясните две характеристики смеси из приведенной выше информации.
Ответ:
а . Фотосинтез — это химический процесс, посредством которого растения, некоторые бактерии и водоросли производят глюкозу и кислород из углекислого газа и воды, используя в качестве источника энергии только свет, который поглощается хлорофиллом.
6CO2 + 6h3O → C6h22O6 + 6O2
Четыре вещества в этом процессе:
1. Углекислый газ = органическое соединение
Углекислый газ = органическое соединение
2. Вода = органическое соединение
3. Глюкоза = органическое соединение
4. Хлорофилл = металлорганическое соединение или комплексное соединение
b. Латунь представляет собой сплав, состоящий в основном из меди, обычно с цинком. Латунь в виде твердого раствора, состоящего цинк и другие металлы в виде растворенных веществ растворяются в меди, взятой в качестве растворителя. Таким образом, латунь соответствует всем критериям решения.
c. Характеристики смесей из приведенной выше информации:
1. Веществами, составляющими смесь, являются два или более элемента или соединения.
2. Соотношение составляющих веществ в смеси может быть переменным.
3. В смеси сохраняются свойства входящих в ее состав веществ.
Страница № 47:
Вопрос 4:
Приведите по два примера
A. Жидкий элемент
B. Газообразный элемент
C. Твердый элемент
D. Гомогенная смесь
E. Коллоид
F. Органическое соединение
Органическое соединение
G. Комплекс соединение
H. Неорганическое соединение
I. Металлоид
J. Элемент с валентностью 1
K. Элемент с валентностью 2
Ответ:
а. Жидкий элемент = ртуть, бром
б. Газообразный элемент = кислород, азот, водород
в. Твердый элемент = натрий, углерод, алюминий
г. Гомогенная смесь = сахар в воде, кукурузное масло, кровь плазма
д. Коллоид = майонез, молоко, масло, желатин, желе, мутная вода
е. Органическое соединение = белки, глюкоза, мочевина, углеводы
г. Комплексное соединение = хлорофилл, гемоглобин, цианокобаламин
ч. Неорганическое соединение = известняк, ржавчина, поваренная соль
i. Металлоид = кремний, германий
j. Элемент с валентностью 1 = натрий, калий, хлор
k. Элемент с валентностью 2 = магний, кальций
Страница № 47:
Вопрос 5:
Напишите названия и символы составных элементов и определите их валентность по молекулярным формулам, приведенным ниже.
KCL, HBR, MGBR 2 , K 2 O, Nah, CaCl 2, CCL 4 , HI, H 2 S, NA 2 S, FES, BACL S, NA 2 S, FES, FES, FES, FES, FES, FES, FES, FES, FES, FES, FS, FES, FES, FES, FES, FES.0347 2
Ответ:
| Соединения | Наименование соединений | Символ составных элементов | Валентность составляющих элементов |
| KCl | Хлорид калия | К, Кл | К = 1, Кл = 1 |
| HBr | Бромоводород | К, Бр | К = 1, Вг = 1 |
| MgBr 2 | Бромид магния | Мг, Бр | Mg = 2, Br = 1 |
| К 2 О | Оксид калия | К, О | К = 1, О = 2 |
| NaH | Гидрид натрия | На, Н | Na = 1, H = 1 |
| CaCl 2 | Хлорид кальция | Ca, Cl | Ca = 2, Cl = 1 |
| ССl 4 | Четыреххлористый углерод | С, Кл | С = 4, Сl = 1 |
| Привет | Йодоводород | Н, я | Н = 1, Я = 1 |
| В 2 Ю | Сероводород | Н, С | Н = 1, Ш = 2 |
| Нет 2 С | Сульфид натрия | На , С | Na = 1 , S = 2 |
| ФС | Сульфид железа (II) | Фе, С | Ж = 2, С = 2 |
| BaCl 2 | Хлорид бария | Ба, Кл | В = 2, Кл = 1 |
Страница № 47:
Вопрос 6:
Химический состав некоторых веществ приведен в следующей таблице. Определите основной тип материи из их.
Определите основной тип материи из их.
| Название вещества | Химический состав | Основной тип вещества |
| Морская вода | h3O + NaCl + MgCl2 | |
| Дистиллированная вода | h3O | |
| Газообразный водород в баллоне | ч3 | |
| Газ в баллоне LPG | C4h20 + C3H8 | |
| Пищевая сода | NaHCO3 | |
| Чистое золото | Авт | |
| Газ в кислородном баллоне | О 2 | |
| Бронза | Cu + Sn | |
| Алмаз | С | |
| Нагретый белый порошок синего стекла | CuSO 4 | |
| Известняк | CaCO 3 | |
| Разбавленная соляная кислота | HCL+ H 2 O |
Ответ:
| Химический состав | Основной вид вещества |
| Морская вода | h3O + NaCl + MgCl2 | смесь |
| Дистиллированная вода | h3O | соединение |
| Газообразный водород в баллоне | h3 | элемент (молекула) |
| Газ в баллоне со сжиженным нефтяным газом | C4h20 + C3H8 | смесь |
| Пищевая сода | NaHCO3 | смесь |
| Чистое золото | Au | элемент |
| Газ в кислородном баллоне | C4h20 + C3H8 | элемент (молекула) |
| Бронза | Cu + Sn | смесь |
| Алмаз | С | элемент (аллотроп) |
| Нагретый белый порошок синего стекла | CuSO4 | соединение |
| Известняк | CaCO3 | соединение |
| Разбавленная соляная кислота | HCL+ h3O | соединение |
Страница № 47:
Вопрос 7:
Напишите научное обоснование.
А. Водород горюч, кислород помогает горению, а вода помогает тушить огонь.
г. Б. Вещества, входящие в состав коллоида, не могут быть разделены обычным фильтрованием.
C. Лимонный щербат имеет сладкий, кисло-соленый вкус и может быть налит в стакан.
D. Твердое вещество обладает свойствами определенной формы и объема.
Ответ:
а. Вода состоит из двух элементов, это водород и кислород. Водород горюч, а кислород нет. Воспламеняемость — это способность горючего материала при достаточном количестве кислорода (или другого окислителя) поддерживать достаточное количество тепловой энергии для поддержания огня после его возгорания. Хотя вода состоит из двух атомов водорода и одного атома кислорода, образуя ионное соединение, она не обладает их характеристиками, потому что соединение не обладает свойствами составляющих его элементов. Поэтому у воды есть свои свойства, которые помогают тушить огонь.
b. Вещества, входящие в состав коллоида, не могут быть разделены обычной фильтрацией, потому что размер частиц в коллоиде (или коллоидном растворе) больше, чем в истинном растворе, но меньше, чем в суспензии. 100нм в диаметре. Размер обычной фильтровальной бумаги составляет более 100 нм, благодаря чему коллоидные частицы проходят через поры фильтровальной бумаги. В связи с этим мы предпочитаем использовать ультрафильтровальную бумагу, чтобы фильтрация коллоидных частиц проходила легко.
100нм в диаметре. Размер обычной фильтровальной бумаги составляет более 100 нм, благодаря чему коллоидные частицы проходят через поры фильтровальной бумаги. В связи с этим мы предпочитаем использовать ультрафильтровальную бумагу, чтобы фильтрация коллоидных частиц проходила легко.
c. Лимонный щербат имеет сладкий, кислый и соленый вкус, и его можно наливать в стакан, потому что кислый вкус указывает на присутствие кислоты, а если кислоту налить в сосуд из металла, то кислота вступает в реакцию с металлом и делает его ядовит по своей природе. Поэтому мы предпочитаем брать сосуд из стеклянного материала.
г. Твердое вещество обладает свойствами определенной формы и объема по следующим причинам:
1) Межмолекулярное притяжение между частицами вещества очень велико.
г. 2) Межъядерное пространство между частицами вещества ничтожно мало.
3) Частицы вещества расположены так близко друг к другу, что вибрируют только в фиксированном положении.
Страница № 47:
Вопрос 8:
Выведите молекулярные формулы соединения, полученного из следующих пар элементов методом перекрестного умножения.
A. C (валентность 4) и Cl (валентность 1)
B. N (валентность 3) и H (валентность 1)
C. C (валентность 4) и O (валентность 2)
D. Ca (валентность 2) & O (валентность 2)
Ответ:
a. C (валентность 4) и Cl (валентность 1):
Шаг 1: Напишите символы радикалов.
C Cl
Шаг 2: Напишите валентность под соответствующим радикалом.
C Cl
4
Шаг 4: Запишите химическую формулу соединения.
CCl 4
b. N (валентность 3) & H (валентность 1)
Шаг 1: Напишите символы радикалов.
N H
Шаг 2: Напишите валентность под соответствующим радикалом.
N H
3
Шаг 4: Запишите химическую формулу соединения.


 п.
п.


 Когда мы рассматриваем светлую поверхность на темном фоне, вследствие несовершенства хрусталика как бы раздвигаются границы этой поверхности, и эта поверхность кажется нам больше своих истинных геометрических размеров. На рисунке за счет яркости цветов белый квадрат кажется, большим относительно черного квадрата на белом фоне.
Когда мы рассматриваем светлую поверхность на темном фоне, вследствие несовершенства хрусталика как бы раздвигаются границы этой поверхности, и эта поверхность кажется нам больше своих истинных геометрических размеров. На рисунке за счет яркости цветов белый квадрат кажется, большим относительно черного квадрата на белом фоне.
 Глаз «охотнее» просматривает
Глаз «охотнее» просматривает

 п.) и частью пространства помещения, которое непосредственно примыкает к объекту.
п.) и частью пространства помещения, которое непосредственно примыкает к объекту. Примером может быть 0,9%(мас./об.) раствора \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса. Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)).
Примером может быть 0,9%(мас./об.) раствора \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса. Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)). Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).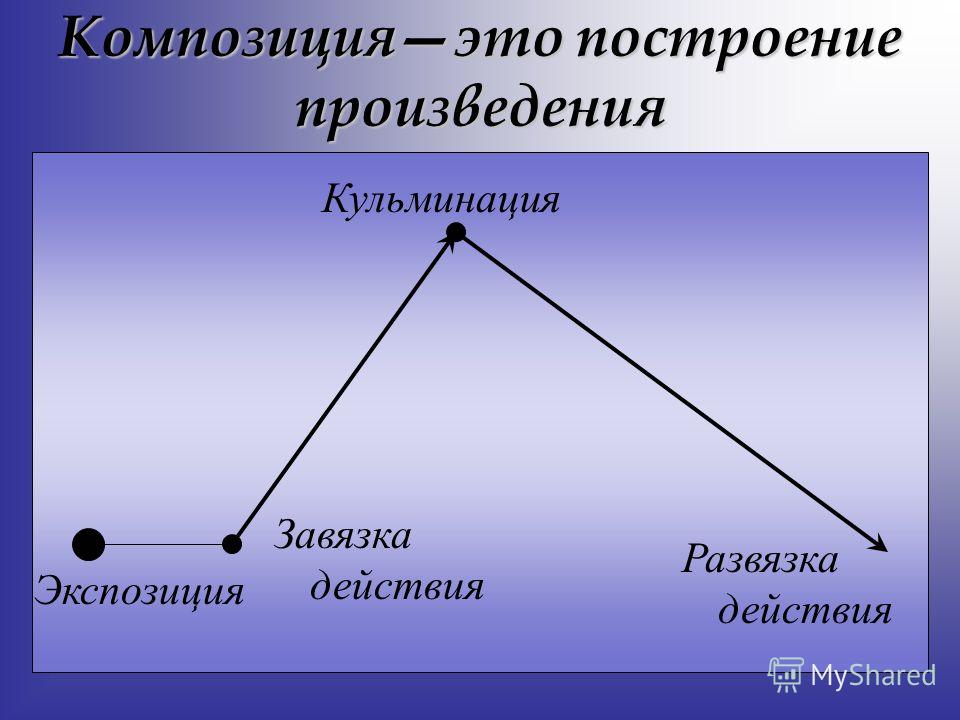 Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]
Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\] Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\]
Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\] %
% Другой — жидкость
фаза с мольными долями компонентов x i .
Другой — жидкость
фаза с мольными долями компонентов x i .
 В этот
температуры из раствора начинает кристаллизоваться лед. Это удаляет
воды из раствора, делая его более концентрированным в уксусной кислоте. Следовательно,
температура замерзания снижается. Этот процесс продолжается до тех пор, пока температура
опускается так, что состав раствора соответствует красно-желтому
границы до точки эвтектики.
В этот
температуры из раствора начинает кристаллизоваться лед. Это удаляет
воды из раствора, делая его более концентрированным в уксусной кислоте. Следовательно,
температура замерзания снижается. Этот процесс продолжается до тех пор, пока температура
опускается так, что состав раствора соответствует красно-желтому
границы до точки эвтектики.