Режим kir: Kyocera 181 оптимальные настройки? — Хабр Q&A
МОУ «КСОШ №6» — Главная страница
С 29 ноября по 3 декабря, 200 активистов и 55 педагогов-кураторов со всей страны зажигают на Финальном мероприятии Всероссийского конкурса «Добро не уходит на каникулы!», входящего в Национальный проект «Образование». Мероприятие проходило в г.Москва.
Школьные добровольческие отряды со всей страны, делятся опытом, учатся писать проекты, общаются с федеральными экспертами.
Ленинградскую область представляют: Логинова Варвара, ученица МОУ «КСОШ №6», Ушакова Анна, активистка Муниципального штаба РДШ и педагог-куратор Зуев Вадим, Муниципальный куратор РДШ.
Вот какими впечатлениями делятся участник мероприятия:
«Каждый день у нас проходило огромное количество мастер-классов на тему бездомных животных, помощь пожилым людям, и работа с детьми, имеющих особенности в развитии.
Я хочу сказать огромное спасибо всем, кто ради нас, ради нашего детского счастья старался.
Спасибо вам большое! Эти 5 дней были нереально крутыми и очень увлекательными» — Ушакова Анна, активист Муниципального штаба РДШ.
«Хочется сказать, что данное мероприятие, подарило мне приятные воспоминания, большое количество нужной и важной информации. Это очень здорово, когда люди в любом возрасте налаживают общий контакт. Без этого в нашем мире — никуда. Так же хочу сказать огромное спасибо всем тем, кто дал мне эту возможность. Возможность приехать сюда, обрести новые знакомства и очень крутую информацию, благодаря которой, наш мир станет еще чуточку добрее. Ведь добро — не уходит на каникулы!» — Логинова Варвара, ученица МОУ «КСОШ №6».
«У педагогов была своя незабываемая программа. Если у ребят были 3 направления на выбор: помощь пожилым, помощь детям с ОВЗ, помощь бездомным животным — то у нас все сразу. Самым важным стал обмен опытом, мы делились нашими практиками работы в добровольческих объединениях, рассказывали как устроена система воспитания в различных регионах, налаживали контакты. Наша команда педагогов и дальше будет взаимодействовать и реализовывать совместные проекты» — Зуев Вадим, Муниципальный куратор РДШ.
МОУ «КСОШ №6» (vk.com)
Стиральная машина LG – ошибка CL — журнал LG MAGAZINE Россия
Компания LG является одним из признанных лидеров мирового рынка в производстве стиральных машин. Широкий модельный ряд, простота управления, непревзойденное качество сборки и долговечность выгодно сочетаются с ценовой политикой.
При правильном использовании и бережном уходе стиральная машина LG прослужит долгие годы и все время эксплуатации будет радовать владельца непревзойденным качеством стирки.
Если же в работе стиральной машины произошли какие-либо неполадки, в подавляющем большинстве случае она предупредит пользователя об этом при помощи специального буквенного кода, выводимого на дисплей. Это очень удобная функция не позволит пользоваться техникой, если есть опасность поломки стиральной машины или эксплуатация производится с нарушениями правил безопасности.
Все коды ошибок вашей стиральной машины LG можно найти в Руководстве пользователя, которое идет в комплекте. Если по какой-то причине отыскать инструкцию не удается, информацию о коде ошибки можно посмотреть на официальном сайте LG в разделе «Часто задаваемые вопросы».
Если по какой-то причине отыскать инструкцию не удается, информацию о коде ошибки можно посмотреть на официальном сайте LG в разделе «Часто задаваемые вопросы».
Один из самых часто встречающихся вопросов касается ошибки CL в стиральных машинах LG.
Происходит это так: при включении стиральной машины на дисплей выводится код СL, который не позволяет проводить никакие действия со стиралкой (выбирать режимы стирки или запускать процесс стирки). При выключении и повторном включении код ошибки не исчезает. Не стоит паниковать. Устранить ошибку CL на стиральной машине LG можно легко своими руками.
СL будет правильнее назвать не «ошибкой», а информационным сообщением. Оно сигнализирует владельцу о том, что был активирован режим защиты от детей. Это очень удобно для семей, где маленький ребенок любит нажимать на все кнопки без разбора и случайно может включить стиральную машину или, наоборот, выключить во время стирки, что может привести к поломке технике. Поэтому в LG разработали режим Child Lock (сокращенно CL), блокирующий кнопки стиральной машины от нажатий.
Если стиральная машина LG выдает код CL, а вы не включали режим защиты от случайных нажатий, возможно, это произошло случайно, либо вы, либо член вашей семье устанавливали Child Lock при предыдущем использовании стиралки LG, так как при выключении режим CL автоматически остается активным.
Как отключить
Для того, чтобы отключить режим Child Lock, необходимо нажать на стиральной машине LG определенную комбинацию клавиш, расположенных на модели управления. Эти комбинации могут быть различными для разных моделей стиральных машин LG. Чтобы узнать точно, какая именно комбинация подходит именно вашей модели, оптимальным будет посмотреть информацию в Руководстве пользователя.
Если сделать это невозможно, то можно попробовать подобрать комбинацию клавиш из числа самых распространенных.
При любой из нижеперечисленных комбинаций нужно зажать одновременно обе кнопки и держать в примерно течение трех секунд. Если комбинация верная, код СL исчезнет с дисплея стиральной машины, и вы снова сможете пользоваться всеми функциями.
Если комбинация верная, код СL исчезнет с дисплея стиральной машины, и вы снова сможете пользоваться всеми функциями.
Самые часто встречающиеся комбинации клавиш для снятия блокировки Child Lock на стиральных машинах LG:
- «Предварительная стирка» + «Супер полоскание».
- «Дополнительная стирка» + «Интенсивная стирка».
- «Температура» + Опционная клавиша.
Обратите внимание: на некоторых моделях стиральных машин LG кнопки снятия блокировки отмечены либо схематическим изображением лица ребенка, либо замка с улыбкой.
Что делать, если не получается отключить CL в штатном режиме?
В некоторых случаях код CL может появляться, если ваша стиральная машина не исправна. В каких случаях это может произойти?
- У вас не получается отключить CL нажатием клавиш.
- Машина выдает код CL в середине цикла стирки, хотя никто его не активировал.

В этих случаях не стоит пытаться устранить причину поломки самостоятельно, так как в подавляющем большинстве случаев ремонт потребует снятия передней панели со стиральной машины. Чтобы избежать окончательного выхода вашей стиральной машины LG из строя, производитель настоятельно рекомендует незамедлительно обратиться в официальный сервисный центр, где специалисты выявят причину неисправности и оперативно устранят ее.
предварительный обзор рейда «Святилище Господства» — World of Warcraft — Новости Blizzard
Пробейтесь в Святилище Господства и одолейте могущественных слуг Сильваны и Изгнанника в захватывающем новом рейде, который станет доступен во 2-м сезоне.
Целую вечность Тюремщик томился в Утробе. Теперь его бесчисленные армии готовятся к бою, и он приступает к заключительному этапу своего великого плана. Хотя ситуация кажется безнадежной, Болвар повелел оставшимся союзникам атаковать сердце Торгаста, чтобы бросить Тюремщику вызов в его же обители.
Боссов в рейде: 10
Режимы: обычный, героический, эпохальный, система поиска
Уровень: 60
Минимальный уровень экипировки для использования системы поиска: 195
7 июля — обычный и героический режим.
14 июля — эпохальный режим и 1-е крыло в системе поиска (Таррагр, Око Тюремщика, Девять).
28 июля — 2-е крыло в системе поиска (раздиратель душ Дормацайн, душа Нер’зула, кузнец боли Разнал).
11 августа — 3-е крыло в системе поиска (стражница Предвечных, писарь судьбы Ро-Кало, Кел’Тузад).
25 августа — 4-е крыло в системе поиска (Сильвана Ветрокрылая).
ТАРРАГР
Неутомимый Таррагр, верный зверь Тюремщика, рыскал по залам Торгаста с тех пор, как первый шпиль Башни вознесся в небо. Это чудовище растоптало в прах бесконечное множество душ — и ждет смертных героев, готовых переступить порог его владений.
ОКО ТЮРЕМЩИКА
Когда Азерот еще был молод, Один отдал свой глаз Мве’зале, чтобы заглянуть в Темные Земли. Однако тщеславный хранитель был обманут, и Тюремщик сделал глаз своим послушным орудием. Его немигающий взгляд позволяет Тюремщику видеть все, что происходит в его владениях – а может, и за их пределами.
ДЕВЯТЬ
Темный пакт, который Сильвана заключила с валь’кирами, сделал ее союзницей Тюремщика. Многие годы крылатые сестры верно служили Темной Госпоже и даже жертвовали собой ради нее. Теперь Сильвана призвала девять валь’кир в последний раз.
ДУША НЕР’ЗУЛА
Нер’зул — первый Король-лич, который должен был подготовить Азерот к правлению Тюремщика. Но он так и не удостоился этой чести. Тюремщик заключил остатки души орка в оболочку из темной стали с острыми шипами и обрек на вечные муки. Тот, кто подойдет к Нер’зулу слишком близко, разделит эту участь.
РАЗДИРАТЕЛЬ ДУШ ДОРМАЦАЙН
Раздиратель душ Дормацайн добывает аниму — могучий источник энергии для армий Тюремщика — из самых свирепых и несгибаемых пленников Торгаста. Он еще не встречал душу, которую не мог бы сломить, но последняя жертва выдержала все обычные пытки. Наслаждаясь вечной яростью своего пленника, Дормацайн уже предвкушает, как будет тысячелетиями искать его слабое место.
КУЗНЕЦ БОЛИ РАЗНАЛ
Кузнец боли Разнал — изобретательный садист, который уже много веков подряд создает и совершенствует смертоносные ловушки и механизмы в Торгасте. Он упивается разносящимися эхом по пустынным залам Башни криками жертв, находя в них наивысшую похвалу своему искусству.
СТРАЖНИЦА ПРЕДВЕЧНЫХ
Притянутая цепями Тюремщика из далекого неизвестного царства, эта неисправная стражница защищает загадочное сокровище, известное как «шифры». Она готова потратить последние силы на то, чтобы уничтожить тех, кто замышляет похищение секретов ее творцов.
ПИСАРЬ СУДЬБЫ РО-КАЛО
Некогда Ро-Кало был писарем судьбы и хранил бесчисленные тайны Кортии, но Верные Утробе схватили его и подчинили воле Тюремщика. Распоряжаясь силой Торгаста, Ро-Кало готов написать новую книгу судеб для Темных Земель.
КЕЛ’ТУЗАД
Зловещий лич Кел’Тузад ждет в конце потока душ, где он может черпать силу из бесконечного источника. Все его планы, все козни вели к этой последней конфронтации, и теперь он готов послужить своему настоящему господину, покончив со смертными героями раз и навсегда.
СИЛЬВАНА ВЕТРОКРЫЛАЯ
Орибос в опасности, и на вершине Святилища начинается отчаянное сражение: между Тюремщиком и смертными героями, которые пытаются его остановить, встала Сильвана Ветрокрылая. Маски сброшены, и королева-банши готова явить свою полную мощь, чтобы защитить Изгнанника и позволить ему осуществить свой великий план.
ТРОФЕИ ИЗ СВЯТИЛИЩА
На пути к верной Изгнаннику королеве-банши вас ждет много сокровищ.
Новые питомцы и средства передвижения
Питомцы: всевидящий глаз (награда за уничтожение Ока Тюремщика), истребляющий глаз (награда за уничтожение Ока Тюремщика в эпохальном режиме), Железный Хват (награда за победу над раздирателем душ Дормацайном), Верный Утробе прислужник (награда за победу над Кел’Тузадом)
Средства передвижения: Отмщение (награда за победу над Сильваной Ветрокрылой в эпохальном режиме), темный скакун Святилища (награда за победу над Девятью), Рука Хрестиморака (награда за достижение «Слава рейдеру Святилища Господства»)
Осколки Господства
Улучшите свое снаряжение осколками Господства. Это новый тип могущественных самоцветов, которые можно получить за победу над боссами в Святилище Господства. Тюремщик уже долгое время использует остатки трудов Резчика Рун для усиления своей армии, но теперь вы сможете захватить их и обратить их силу против самого Изгнанника. Осколки излучают рунную магию трех разных типов: крови, льда и нечестивости. Эти жуткие самоцветы можно вставлять в гнезда Господства, таким образом усиливая наносящие урон, защитные или исцеляющие способности персонажа. Эффекты каждого осколка действуют где угодно, но если вы инкрустируете свое снаряжение тремя осколками одного типа, вы составите руническую надпись. Она дает вам могущественный положительный эффект, еще больше повышающий вашу эффективность в бою, пока вы находитесь в Утробе, Торгасте или Святилище Господства. Для каждого класса будет доступно по пять различных предметов снаряжения с гнездами Господства, которые можно получить в рейде. За победу над боссами в рейде вы также сможете получить стигийские угли, необходимые для улучшения осколков Господства и повышения мощи их бонусов.
Осколки излучают рунную магию трех разных типов: крови, льда и нечестивости. Эти жуткие самоцветы можно вставлять в гнезда Господства, таким образом усиливая наносящие урон, защитные или исцеляющие способности персонажа. Эффекты каждого осколка действуют где угодно, но если вы инкрустируете свое снаряжение тремя осколками одного типа, вы составите руническую надпись. Она дает вам могущественный положительный эффект, еще больше повышающий вашу эффективность в бою, пока вы находитесь в Утробе, Торгасте или Святилище Господства. Для каждого класса будет доступно по пять различных предметов снаряжения с гнездами Господства, которые можно получить в рейде. За победу над боссами в рейде вы также сможете получить стигийские угли, необходимые для улучшения осколков Господства и повышения мощи их бонусов.
Чтобы улучшить осколки, поговорите с костоплавом Гейрмир в Кортии после выполнения задания «Фокусировка взгляда» в 3-й главе сюжетной линии кампании в обновлении «Цепи Господства».
НОВЫЕ ДОСТИЖЕНИЯ, НОВЫЕ НАГРАДЫ
Заработайте перечисленные ниже достижения, чтобы получить ужасающее средство передвижения и достойное вашего триумфа звание.
«Слава рейдеру Святилища Господства»: заработайте следующие достижения в рейде «Святилище Господства»: «Это самая лучшая парочка», «Эти глаза напротив», «Девять судеб», «Танго терзателя», «Дома мы тренировались на подземных крысах», «Душебойка», «Знание – сила», «Безупречная судьба», «Вместе навсегда», «Мир как призма».
Наградное средство передвижения: Рука Хрестиморака
«Эпохальный режим: Сильвана Ветрокрылая»: победите Сильвану Ветрокрылую в Святилище Господства в эпохальном режиме.
Наградное звание: «Сокрушитель оков»
ВРЕМЕННО ДОСТУПНЫЕ ДОСТИЖЕНИЯ
Игроки, которые одержат победу над Сильваной Ветрокрылой в героическом или эпохальном режиме до выхода рейда более высокого уровня, смогут заслуженно похвастаться следующими достижениями.
«Герой своего времени: Сильвана Ветрокрылая»: победите Сильвану Ветрокрылую в Святилище Господства в героическом или более сложном режиме до выхода рейда более высокого уровня.
«На кромке лезвия: Сильвана Ветрокрылая»: победите Сильвану Ветрокрылую в Святилище Господства в эпохальном режиме до выхода рейда более высокого уровня.
СПб ГБУЗ Психоневрологический диспансер №2 |
Уважаемые сограждане!
В случае если Вы почувствовали симптомы ОРВИ (слабость, повышение температуры, затруднение дыхания, сухой кашель, головная боль, тяжесть в грудной клетке, боль в горле) – пожалуйста, обратитесь за помощью в поликлинику по месту прикрепления! При посещении диспансера на себе необходимо иметь МЕДИЦИНСКУЮ МАСКУ и ПЕРЧАТКИ.
РЕЖИМ РАБОТЫ ДИСПАНСЕРА (УЧАСТКОВЫХ ВРАЧЕЙ)
Понедельник-пятница — 9:00-20:00
Суббота — 9:00-15:00 (дежурная служба)
Воскресенье выходной день.
Режим работы врачей участковых-психиатров амбулаторного отделения Выборгского района
- Четные числа месяца в рабочие дни (понедельник-пятница) — 9:00-16:42
(прием врача участкового с 9:00-14:00; с 14:00-16:42 посещение врачом пациентов на дому)
- Нечетные числа месяца в рабочие дни (понедельник-пятница) — 12:18-20:00
(с 12:18-15:00 посещение врачом пациентов на дому; прием врача участкового с 15:00-20:00)
Режим работы врачей участковых-психиатров амбулаторного отделения Калининского района
- Нечетные числа месяца в рабочие дни (понедельник-пятница) — 9:00-16:42
(прием врача участкового с 9:00-14:00; с 14:00-16:42 посещение врачом пациентов на дому)
- Четные числа месяца в рабочие дни (понедельник-пятница) — 12:18-20:00
(с 12:18-15:00 посещение врачом пациентов на дому; прием врача участкового с 15:00-20:00)
РЕЖИМ РАБОТЫ ОТДЕЛЕНИЯ ПЛАТНЫХ УСЛУГ
(Выдача справок на право владения оружием, управлением транспортным средством, допуск к работе или определенным видам деятльности)
При себе иметь паспорт и СНИЛС.
Понедельник с 9:00 до 17:00, обед с 13:30 до 14:00;
Вторник с 9:00 до 17:00, обед с 13:30 до 14:00;
Среда с 9:00 до 17:00, обед с 13:30 до 14:00;
Четверг 9:00 до 17:00, обед с 13:30 до 14:00;
Пятница 9:00 до 17:00, обед с 13:30 до 14:00;
Суббота и воскресенье выходные
Режим работы врачебной комиссии отделения платных услуг для работы с вредными и опасными условиями труда
Понедельник с 9:30 до 17:00, обед с 13:30 до 14:00;
Вторник с 9:30 до 14:00
Среда с 9:30 до 17:00, обед с 13:30 до 14:00;
Четверг с 9:30 до 14:00
Пятница с 9:30 до 14:00
Суббота и воскресенье выходные.
Оплата производится через кассовый аппарат.
Банковские карты к оплате не принимаются. Только наличный расчет.
кир-1а / тсек
| |
Система TSEC / K1-1A состоит
списка кодовых ключей AKAK 3662 (AKAK), устройство смены кодов SEC KIK-18A / T
ключ (КИК) и компьютер-дозиметр КИР-1А \ ЦЕСК (КИР). (Изображение через Global Security) (Изображение через Global Security) |
AKAK 3662 — это операционный код список ключей для TSEC / K1-1A система. Редакции состоят из 28 оперативных и двух аварийных. таблицы, содержащие настройки кода на 28-дневной основе.Две чрезвычайные ситуации таблицы не разрешены к использованию. Отдельные столы состоят из 64 металлические штифты в КИК. В каждой таблице представлены две ключевые настройки, обозначенные «А» + «В» (день 1 и день 2), чтобы воздушные суда, находящиеся в воздухе, время изменения (2400Z) может перейти к следующей криптопеременной без меняют ключи их комплекта. Редакции AKAK засекречены КОНФИДЕНЦИАЛЬНО. и отмечены CRYPTO. Отдельные таблицы относятся к категории КОНФИДЕНЦИАЛЬНО.
КИК-18А / ЦЭК,
ключ смены кода
механическое устройство, используемое для
криптографическим ключом KIR или KIT.Металлические штифты, которые выступают
с одного конца устройства, подключите его к блоку смены кода
KIR или KIT для установки кода. После установки штифтов вручную KIK может
использоваться для ввода любого количества KIR или KIT. KIK засекречен
КОНФИДЕНЦИАЛЬНО при установке с помощью кода и БЕЗКЛАССИФИЦИРОВАННО, если не установлено.
После установки штифтов вручную KIK может
использоваться для ввода любого количества KIR или KIT. KIK засекречен
КОНФИДЕНЦИАЛЬНО при установке с помощью кода и БЕЗКЛАССИФИЦИРОВАННО, если не установлено.
Запросчик КИР-1А \ ЦЭК компьютер используется в основном в наземно-наземный опросчик систем IFF, оборудованных MARK XII. После будучи криптографическим ключом KIK, KIR может вычислять индивидуально уникальные допросы, которые передаются как вызовы через дознавателя к неопознанному самолету.Он также проверяет достоверность закодированных ответов транспондера воздушного судна. В KIK классифицирован как КОНФИДЕНЦИАЛЬНО. Инструкции по обращению содержатся в ТБ 380-41 и руководство АНБ КАМ 25.
| Эта печатная плата была идентифицирована как принадлежащая Устройство КИР-1А. (фото E-bay) |
Как
пример конкретного применения, КИР-1А используется в
Подсистема идентификации друга или врага (IFF), часть
Комплекс ракетного вооружения «Стингер». Оператор подключает IFF
запросчик к оружию с помощью соединительного кабеля IFF. Когда
связан с выстрелом из оружия Stinger, дознаватель IFF
способный передать вызов (допрос) потенциальному
цель. Если получен неправильно закодированный ответ, самолет
классифицирован как «неизвестный» (возможно, враг).
Оператор подключает IFF
запросчик к оружию с помощью соединительного кабеля IFF. Когда
связан с выстрелом из оружия Stinger, дознаватель IFF
способный передать вызов (допрос) потенциальному
цель. Если получен неправильно закодированный ответ, самолет
классифицирован как «неизвестный» (возможно, враг).
Кир | Волшебные каникулы вики
«Хугити-хам, фноогити-дверь, руни-дугити!»
-Кир, собирается дать игроку синюю липкую лягушку из горшка HP.
Кир — один из семи яичных персонажей Magical Starsign. Кир — представитель магии земли, как и Мокка. Кир не имеет отношения к общей истории игры. Несмотря на это, Кир — один из немногих персонажей-яиц, у которых есть реплики при использовании своих способностей вне боя.
Внешний вид []
Кир — это небольшая светло-зеленая статуя какого-то дизайна. Он имеет некоторое сходство с японскими статуями с закрученными акцентами, хотя точное происхождение неясно. Это может быть вдохновлено буддийскими статуями. У Кира также есть перо на голове, напоминающее корону, большие стороны в форме ушей на голове и бесконечно закрытые глаза.
Это может быть вдохновлено буддийскими статуями. У Кира также есть перо на голове, напоминающее корону, большие стороны в форме ушей на голове и бесконечно закрытые глаза.
При ходьбе Кир ходит из стороны в сторону, наклоняясь в противоположных направлениях при движении.
В бою Кир будет стоять, постоянно отрывая голову, и постоянно летит вверх. Они охраняют, склонив голову. При использовании магии их голова вращается на месте, прежде чем они наклонятся вперед. При использовании своих физических способностей Кир будет скользить вперед, кланяться, и их голова раскалывается, создавая частицы с различными эффектами, а затем скользит обратно на место.При использовании предмета Кир будет наклоняться назад. Выигрывая битву, Кир будет несколько раз покачиваться вперед и назад, прежде чем повернуть голову и открыть ее, а затем встать и снова повернуть голову.
Метод получения []
| Кир | |
|---|---|
| Оформление Кир.  | |
Выравнивание | Земля |
Пол | Неизвестно |
Виды | Неизвестно |
Один из способов получить Kir — это взаимодействие в режиме тегов между несколькими игроками или системами DS, в которых также есть игра.Поскольку магический элемент Кира является одним из пяти основных элементов, его можно получить в первых четырех яйцах в режиме тегов. Яйца выдаются игроку, когда он достигает определенного количества амиго в его или ее списке амиго.
Кир возможно в следующих яйцах …
- 1 амиго — 1-е яйцо (любой элемент, кроме темного или светлого)
- 15 Amigos — 2-е яйцо (любой элемент, кроме темного или светлого)
- 30 Amigos — 3-е яйцо (любой элемент, кроме темного или светлого)
- 60 Amigos — 4th Egg (Любой элемент, кроме Dark или Light)
Other Egg Персонажи пяти основных элементов могут быть найдены в этих яйцах, поэтому есть вероятность, что игрок не получит Кира в качестве игрового персонажа.
Чтобы вылупить яйцо Кира или других, обычно требуется от пяти до шести взаимодействий в режиме тегов с разными людьми. Если несколько раз попытаться пометить одного игрока или одну ячейку сохранения, вылупление может занять в четыре раза больше времени.
Способности и навыки []
Физический навык
Кир обладает уникальным умением, известным как Открытие. Этот навык заставляет Кир двигаться к противнику и раскалывать ему голову, создавая один из как минимум трех эффектов. Эффект непростой линии, который может вызвать состояние головокружения, эффект пыли, который может вызвать статус камня, и эффект полного взрыва, который может вызвать статус выжженного
Внебоевые умения
Когда Кир является партией, они будут вмешиваться, когда игрок использует горшок HP, и удаляют синий липкий туман изнутри.Это произойдет независимо от того, действительно ли команда игрока использовала банк HP. Кажется, что это прекращается, когда у игрока в инвентаре есть пять синих мармеладных лягушек.
Магия
Также Кир может выучить любое заклинание из Книги, как и главные герои.
Происхождение имени []
Кир — напиток, состоящий из белого сухого вина или шампанского, сдобренного черной смородиной.
Интересные факты []
- Кир — один из немногих персонажей-яиц, у которых есть диалоги, эта черта общая с Фондю и Ноггом.Кир будет говорить, когда берет синюю липкую лягушку из горшка HP.
6CH RC Flight Simulator JTL-0904A Поддержка Real RF7 G7 Phoenix 5.0 XTR Drone Mode KIR
Описание:
100% абсолютно новый и качественный
Функции:
Функции:
1. Установка с одним ключом G7.0, оснащенная Real RF7 G7 / G6.5 (единственный серийный номер). Поддержка онлайн-обновления.
2. Phoenix 5.0 поддерживает онлайн-обновление.
3. Язык :. Китайский и английский
4. Установка среды :. (32-разрядная, 64-разрядная) XP, Windows7, Windows8, Windows10, Vista
Опора рукоятки тренажера:
Новый G7.0, G6.5, — G4
Новый Phoenix 5. 0 — 2.5 версия XTR
Пожалуйста, обратите внимание на установку:
1. Сначала попробуйте найти на компакт-диске значок «автозапуск», это руководство по быстрой установке.
2. Перед запуском любой программы, пожалуйста, установите «DirectX9.0» с компакт-диска.
3. Запустите консоль симулятора SimLauncher2017.exe от имени администратора с компакт-диска и переключитесь на другую программу более легко и удобно.
Или переключите переключатель в правом нижнем углу ручки эмулятора USB — четыре скользящие шестерни на ваш выбор.
4. После запуска Simulator Switcher для выбора имени программного обеспечения запустите G7.0 или Phoenix 5.0 XTR
1. 27418829-E1-5140106092
2. 22850737-E2-3850104361
3. 78396652-E3-7440103834
4. 13144997-E4-6630107326
5. 78779710-E5-87
0 — 2.5 версия XTR
Пожалуйста, обратите внимание на установку:
1. Сначала попробуйте найти на компакт-диске значок «автозапуск», это руководство по быстрой установке.
2. Перед запуском любой программы, пожалуйста, установите «DirectX9.0» с компакт-диска.
3. Запустите консоль симулятора SimLauncher2017.exe от имени администратора с компакт-диска и переключитесь на другую программу более легко и удобно.
Или переключите переключатель в правом нижнем углу ручки эмулятора USB — четыре скользящие шестерни на ваш выбор.
4. После запуска Simulator Switcher для выбора имени программного обеспечения запустите G7.0 или Phoenix 5.0 XTR
1. 27418829-E1-5140106092
2. 22850737-E2-3850104361
3. 78396652-E3-7440103834
4. 13144997-E4-6630107326
5. 78779710-E5-87
 2. Установлено хорошее программное обеспечение XTR, откройте программное обеспечение, наведите указатель на верхнюю часть панели каталогов «дистанционное управление», а затем укажите всплывающее окно «Распределение каналов», канал установлен на диаграмме выше, сигнал не может быть установлен, если есть нет распределения каналов, то заменить USB-интерфейс компьютера еще даже пытается.
3. настройки канала — Выберите модель вертолета (нефтяная машина тоже в порядке), а затем смоделируйте всю тонкую настройку центра дистанционного управления, несколько раз подавите наиболее значительный отрыв под штангой (не такое действие приведет к «калибровке нейтрального положения», когда элемент дроссельной заслонки не может быть нейтральным, и, следовательно, не может быть нормальным взлетом), а затем помещен в середину тяги дроссельной заслонки, после столбца каталога компьютерного программного обеспечения «дистанционное управление» ниже, чтобы узнайте «калибровку нейтрального положения» калибровку, калибровку, начало моделирования после точки завершения — проверьте, какие каналы не работают (по всему периметру кромки, настройтесь на реальную машину, например, в том же направлении, что и регулятор) — — если да, то какой канал не используется, тогда настройки обратного канала, которые будут управлять правой стороной канала с «+» на «-» (или наоборот), как показано на рисунке справа, значок повторной калибровки — — — настройки канала верны, можно начинать играть!
4.
2. Установлено хорошее программное обеспечение XTR, откройте программное обеспечение, наведите указатель на верхнюю часть панели каталогов «дистанционное управление», а затем укажите всплывающее окно «Распределение каналов», канал установлен на диаграмме выше, сигнал не может быть установлен, если есть нет распределения каналов, то заменить USB-интерфейс компьютера еще даже пытается.
3. настройки канала — Выберите модель вертолета (нефтяная машина тоже в порядке), а затем смоделируйте всю тонкую настройку центра дистанционного управления, несколько раз подавите наиболее значительный отрыв под штангой (не такое действие приведет к «калибровке нейтрального положения», когда элемент дроссельной заслонки не может быть нейтральным, и, следовательно, не может быть нормальным взлетом), а затем помещен в середину тяги дроссельной заслонки, после столбца каталога компьютерного программного обеспечения «дистанционное управление» ниже, чтобы узнайте «калибровку нейтрального положения» калибровку, калибровку, начало моделирования после точки завершения — проверьте, какие каналы не работают (по всему периметру кромки, настройтесь на реальную машину, например, в том же направлении, что и регулятор) — — если да, то какой канал не используется, тогда настройки обратного канала, которые будут управлять правой стороной канала с «+» на «-» (или наоборот), как показано на рисунке справа, значок повторной калибровки — — — настройки канала верны, можно начинать играть!
4. например, вертолет взлетел слишком тяжело, укажите «модель», а затем укажите «физические параметры изменения», вес вертолета на 1 кг меньше, это будет более близко к реальной чувствительности машины. Заземлен и может также модифицировать симулятор в соответствующих параметрах, таких как регулировка чувствительности гироскопа и т. Д., Для достижения наилучшего полета вертолета. Следует напомнить, что симуляция сложная, и та же самая настоящая машина, и хотелось бы летать на вертолете, зависать или летать и т. Д.также необходимо практиковать медленно, или не касаться практики.
Это имитатор полета с дистанционным управлением, подключенный к компьютеру, а не к радио.
Не поддерживает физическое дистанционное управление самолетом Питание от компьютера USB, батарея не требуется
Пожалуйста, обрати внимание:
Режим 1 — ручка газа справа
Режим 2 — ручка газа слева Спецификация:
Материал: пластик
Черный цвет
Размер: приложение. 20 x 20 x 10 см / 7,87 x 7,87 x 3,93 дюйма
Количество: 1 комплект
Примечание:
Переход: 1 см = 10 мм = 0,39 дюйма
Нет розничной упаковки.
например, вертолет взлетел слишком тяжело, укажите «модель», а затем укажите «физические параметры изменения», вес вертолета на 1 кг меньше, это будет более близко к реальной чувствительности машины. Заземлен и может также модифицировать симулятор в соответствующих параметрах, таких как регулировка чувствительности гироскопа и т. Д., Для достижения наилучшего полета вертолета. Следует напомнить, что симуляция сложная, и та же самая настоящая машина, и хотелось бы летать на вертолете, зависать или летать и т. Д.также необходимо практиковать медленно, или не касаться практики.
Это имитатор полета с дистанционным управлением, подключенный к компьютеру, а не к радио.
Не поддерживает физическое дистанционное управление самолетом Питание от компьютера USB, батарея не требуется
Пожалуйста, обрати внимание:
Режим 1 — ручка газа справа
Режим 2 — ручка газа слева Спецификация:
Материал: пластик
Черный цвет
Размер: приложение. 20 x 20 x 10 см / 7,87 x 7,87 x 3,93 дюйма
Количество: 1 комплект
Примечание:
Переход: 1 см = 10 мм = 0,39 дюйма
Нет розничной упаковки. Возможны отклонения в 1-2 см из-за ручного измерения.Пожалуйста, убедитесь, что вы не возражаете, прежде чем сделать ставку.
Из-за разницы между различными мониторами изображение может не отражать реальный цвет изделия. Спасибо! В коплект входит:
1 x 6-канальный имитатор полета XTR (режим 2)
1 DVD-диск с программным обеспечением для симулятора (демонстрация других аксессуаров на картинке не включена).
Возможны отклонения в 1-2 см из-за ручного измерения.Пожалуйста, убедитесь, что вы не возражаете, прежде чем сделать ставку.
Из-за разницы между различными мониторами изображение может не отражать реальный цвет изделия. Спасибо! В коплект входит:
1 x 6-канальный имитатор полета XTR (режим 2)
1 DVD-диск с программным обеспечением для симулятора (демонстрация других аксессуаров на картинке не включена).Мутация, связанная с синдромом Барттера, блокирует каналы Kir 1.1a (Romk1) в закрытом состоянии
Abstract
Мутации во внутреннем выпрямляющем почечном канале K + канал, Кир 1.1a (ROMK), были связаны с синдромом Барттера, семейной нефропатией, связанной с истощением соли. Одна мутация, вызывающая заболевание, удаляет последние 60 аминокислот (332–391), вовлекая ранее недооцененный домен, крайний конец COOH, как необходимый функциональный элемент. В соответствии с этой гипотезой, усеченные каналы (Kir 1.1a 331X) нефункциональны. В настоящем исследовании роли этой области систематически оценивались. При коэкспрессии с субъединицами дикого типа Kir 1.1a 331X оказывал отрицательный эффект, демонстрируя, что мутантный канал синтезируется и способен к олигомеризации.Плазмалемма слитой конструкции Kir 1.1a 331X green fluorescent protein (GFP) была неотличима от GFP-канала дикого типа, демонстрируя, что мутантные каналы экспрессируются на плазматической мембране ооцитов в непроводящей или закрыто-закрытой конформации. Инкрементальная реконструкция COOH-конца идентифицировала аминокислоты 332–351 как критические остатки для восстановления активности канала и раскрыла природу функционального дефекта. Мутантные каналы, усеченные на крайней границе искомой области (Kir 1.1a 351X) демонстрируют заметное дезактивационное поведение, характеризующееся частым пребыванием в долгоживущем закрытом состоянии. Критический анализ доминирующего отрицательного эффекта Kir 1.1a 331X предполагает молекулярный механизм, лежащий в основе аберрантной стабилизации в закрытом состоянии. Совместная экспрессия различных доз мутанта с субъединицами дикого типа давала промежуточный доминантный негативный эффект, тогда как включение одного мутанта в тетрамерный конкатемер давало полный доминантный негативный эффект.
При коэкспрессии с субъединицами дикого типа Kir 1.1a 331X оказывал отрицательный эффект, демонстрируя, что мутантный канал синтезируется и способен к олигомеризации.Плазмалемма слитой конструкции Kir 1.1a 331X green fluorescent protein (GFP) была неотличима от GFP-канала дикого типа, демонстрируя, что мутантные каналы экспрессируются на плазматической мембране ооцитов в непроводящей или закрыто-закрытой конформации. Инкрементальная реконструкция COOH-конца идентифицировала аминокислоты 332–351 как критические остатки для восстановления активности канала и раскрыла природу функционального дефекта. Мутантные каналы, усеченные на крайней границе искомой области (Kir 1.1a 351X) демонстрируют заметное дезактивационное поведение, характеризующееся частым пребыванием в долгоживущем закрытом состоянии. Критический анализ доминирующего отрицательного эффекта Kir 1.1a 331X предполагает молекулярный механизм, лежащий в основе аберрантной стабилизации в закрытом состоянии. Совместная экспрессия различных доз мутанта с субъединицами дикого типа давала промежуточный доминантный негативный эффект, тогда как включение одного мутанта в тетрамерный конкатемер давало полный доминантный негативный эффект. Это идентифицирует крайний конец COOH как важный домен взаимодействия субъединиц, контролирующий эффективность олигомеризации.В совокупности эти наблюдения обеспечивают механистическую основу потери функции в одной конкретной мутации, вызывающей Барттера, и идентифицируют структурный элемент, который контролирует занятость в открытом состоянии и определяет олигомеризацию субъединиц. Основываясь на перекрывающихся функциях этого домена, мы предполагаем, что межсубъединичные взаимодействия в пределах конца COOH могут регулировать энергетику открытия канала.
Это идентифицирует крайний конец COOH как важный домен взаимодействия субъединиц, контролирующий эффективность олигомеризации.В совокупности эти наблюдения обеспечивают механистическую основу потери функции в одной конкретной мутации, вызывающей Барттера, и идентифицируют структурный элемент, который контролирует занятость в открытом состоянии и определяет олигомеризацию субъединиц. Основываясь на перекрывающихся функциях этого домена, мы предполагаем, что межсубъединичные взаимодействия в пределах конца COOH могут регулировать энергетику открытия канала.
Ключевые слова: калий, канал, гейт, олигомеризация субъединицы, зеленый флуоресцентный белок
ВВЕДЕНИЕ
Выпрямляющий внутрь канал K + , Кир 1.1 (ROMK), играет важную роль в функции почек (Hebert, Wang 1997; Ho et al. 1993). Убедительные корреляционные наблюдения убедительно подтверждают идею о том, что продукт гена Kir 1.1 кодирует порообразующую субъединицу определенных АТФ-чувствительных каналов K + , которые влияют на способность концентрировать мочу и гомеостаз калия (Hebert and Wang 1997). Действительно, иммунодетектируемый белок Kir1.1 ограничен апикальной мембраной толстой восходящей конечности, дистальным канальцем и собирательным каналом (Mennitt et al.1997; Xu et al. 1997; Kohda et al. 1998), где эти уникальные каналы K ATP экспрессируются исключительно (Bleich et al. 1990; Wang et al. 1990a, Wang et al. 1990b; Frindt and Palmer 1989). Более того, исследования гетерологичной экспрессии в ооцитах Xenopus показали, что Kir 1.1 демонстрирует почти идентичную проводимость одного канала и кинетику высокой открытой вероятности, что и нативный секреторный канал K + (Palmer et al. 1997). Совместная экспрессия АТФ-связывающего кассетного белка, регулятора трансмембранной проводимости при муковисцидозе, необходима для передачи АТФ (Ruknudin et al.1998) и чувствительность к глибенкламиду на Kir 1.1 (McNicholas et al. 1996; Ruknudin et al. 1998), а также для повторения полного репертуара поведения нативных каналов. В этом отношении секреторный канал K ATP почки, как предполагалось, демонстрирует состав субъединиц мультимерного канала Kir 1.
Действительно, иммунодетектируемый белок Kir1.1 ограничен апикальной мембраной толстой восходящей конечности, дистальным канальцем и собирательным каналом (Mennitt et al.1997; Xu et al. 1997; Kohda et al. 1998), где эти уникальные каналы K ATP экспрессируются исключительно (Bleich et al. 1990; Wang et al. 1990a, Wang et al. 1990b; Frindt and Palmer 1989). Более того, исследования гетерологичной экспрессии в ооцитах Xenopus показали, что Kir 1.1 демонстрирует почти идентичную проводимость одного канала и кинетику высокой открытой вероятности, что и нативный секреторный канал K + (Palmer et al. 1997). Совместная экспрессия АТФ-связывающего кассетного белка, регулятора трансмембранной проводимости при муковисцидозе, необходима для передачи АТФ (Ruknudin et al.1998) и чувствительность к глибенкламиду на Kir 1.1 (McNicholas et al. 1996; Ruknudin et al. 1998), а также для повторения полного репертуара поведения нативных каналов. В этом отношении секреторный канал K ATP почки, как предполагалось, демонстрирует состав субъединиц мультимерного канала Kir 1. 1 и модификатора белка ABC, аналогичный каналам Kir 6.x / SUR в сердце и островковых бета-клетках (Babenko et al. . 1998).
1 и модификатора белка ABC, аналогичный каналам Kir 6.x / SUR в сердце и островковых бета-клетках (Babenko et al. . 1998).
Окончательная связь между геном Kir1.1, почечным секреторным каналом K ATP и функцией почек (Simon et al.1996b; Karolyi et al. 1997) был установлен в результате семейной нефропатии, связанной с истощением соли, называемой синдромом Барттера (Bartter et al. 1962). В результате генетических дефектов в механизме концентрирования почек заболевание характеризуется совокупностью нарушений жидкости и электролитов, включая полиурию, гипокалиемию, метаболический алкалоз и гипотензию, которые напоминают наблюдаемые при хроническом применении петлевых диуретиков (Guay-Woodford 1998). . Фактически, мутации в основных компонентах реабсорбтивного аппарата NaCl в толстой восходящей части петли Генле были связаны с этим генетически гетерогенным заболеванием (Simon et al.1996a, Саймон и др. 1996b, Саймон и др. 1996c; Karolyi et al. 1997). В соответствии с важной ролью секреторного канала K ATP в толстой восходящей конечности Henle (Giebisch 1998), мутации потери функции в гене Kir 1. 1 были идентифицированы у нескольких родственников, страдающих синдромом Барттера.
1 были идентифицированы у нескольких родственников, страдающих синдромом Барттера.
Обнаружение болезнетворных мутаций в Kir1.1a не только дает ценную информацию о роли этого канала в здоровье и болезнях, но также дает иллюстративные подсказки о структурных детерминантах функции.Подобно другим членам класса выпрямляющих внутрь каналов K + , функциональный канал образован тетрамерной сборкой субъединиц Kir 1.1. Каждая субъединица состоит из двух предполагаемых трансмембранных доменов, которые фланкируют «P» петлю, содержащую фильтр селективности калия и другие детерминанты пути проникновения (Nichols and Lopatin 1997). Трансмембранное ядро ограничено цитоплазматическими NH 2, — и COOH-концевыми доменами, играющими роль в регуляции каналов (Fakler et al.1996; Xu et al. 1996; Choe et al. 1997; MacGregor et al. 1998), проводимости (Taglialatela et al. 1994; Yang et al. 1995a) и олигомеризации (Tinker et al. 1996; Koster et al. 1998). Мутации в каждом из этих доменов связаны с синдромом Барттера. Многие мутации вводят бессмысленные кодоны или сдвиги рамки считывания на конце NH 2 , производя усеченные белки с очевидными последствиями потери функции (Simon et al. 1996b; Karolyi et al. 1997). Обнаружена мутация в основном домене, которая изменяет путь проникновения (Derst et al.1998). Другие мутации нарушают сайт фосфорилирования регуляторной протеинкиназы А, Ser 219, предположительно, влияя на его состояние фосфорилирования или способность модулировать активность канала (Simon et al. 1996b; Derst et al. 1997).
Многие мутации вводят бессмысленные кодоны или сдвиги рамки считывания на конце NH 2 , производя усеченные белки с очевидными последствиями потери функции (Simon et al. 1996b; Karolyi et al. 1997). Обнаружена мутация в основном домене, которая изменяет путь проникновения (Derst et al.1998). Другие мутации нарушают сайт фосфорилирования регуляторной протеинкиназы А, Ser 219, предположительно, влияя на его состояние фосфорилирования или способность модулировать активность канала (Simon et al. 1996b; Derst et al. 1997).
Хотя крайнему COOH-концу канала не приписано никакой конкретной функции, связь между мутацией, которая удаляет последние 60 аминокислот (сдвиг рамки считывания T332 – K333), и болезнью Барттера (Simon et al. 1996b) предполагает важную роль для этого ранее нераспознанного домена.Как и было предсказано на основании фенотипа Барттера, мы обнаружили, что делеция СООН-концевых 60 аминокислотных остатков делает каналы неактивными. В настоящем исследовании мы систематически оценивали возможные функциональные роли крайнего COOH-терминального домена Kir 1. 1a. Выяснив механизм, лежащий в основе дефекта, мы обнаружили, что крайний конец COOH действует как обязательный детерминант стробирования канала, поддерживая канал в стабильном открытом состоянии.
1a. Выяснив механизм, лежащий в основе дефекта, мы обнаружили, что крайний конец COOH действует как обязательный детерминант стробирования канала, поддерживая канал в стабильном открытом состоянии.
МЕТОДЫ
кДНК и мутагенез
Настоящее исследование сосредоточено на последствиях COOH-терминальных мутаций в Kir 1.1. Чтобы гарантировать, что различия в функциональной экспрессии являются результатом изменений в открытой рамке считывания (ORF) 1 , а не изменений в 3′-нетранслируемых областях (UTR), 3′-UTR была удалена из крысы дикого типа Kir 1.1a. (Ho et al. 1993) и конструкции мутантной кДНК с COOH-концевой делецией. Мутагенез выполняли с помощью ПЦР с расширением перекрывания (Ho et al. 1989). Делеционные мутанты (Kir 1.1a 331X, Kir 1.1a 341X, Kir 1.1a 351X, Kir 1.1a 361X и Kir 1.1a 366X) были сконструированы путем введения трех стоп-кодонов в рамку считывания в соответствующие места.Для создания Kir 1.1a Δ332–351 продукт ПЦР, кодирующий аминокислоты 352–391, был лигирован с уникальным сайтом NspV (см. Ниже). Все кДНК были субклонированы между 5 ‘и 3’ UTR гена β-глобина Xenopus в модифицированном векторе pSD64 для повышения эффективности экспрессии (Krieg and Melton 1984). Этот вектор также содержит последовательность полиаденилата в 3′-UTR (dA 23 dC 30 ). Соответствующую последовательность кДНК проверяли секвенированием терминации красителя (ABI Prism).
Ниже). Все кДНК были субклонированы между 5 ‘и 3’ UTR гена β-глобина Xenopus в модифицированном векторе pSD64 для повышения эффективности экспрессии (Krieg and Melton 1984). Этот вектор также содержит последовательность полиаденилата в 3′-UTR (dA 23 dC 30 ). Соответствующую последовательность кДНК проверяли секвенированием терминации красителя (ABI Prism).
Строительство Конкатемера Кир 1.1a
Чтобы критически проверить доминантный негативный эффект Kir 1.1a 331X, были созданы три отдельных конкатемерных конструкции кДНК. В одной конструкции четыре субъединицы Kir 1.1a дикого типа (4wt) были ковалентно связаны вместе. Две другие конструкции состояли из трех субъединиц дикого типа, соединенных с одной Kir 1.1a 331X либо в NH 2 — (1mut + 3wt), либо в концевом положении COOH- (3wt + 1mut) тандемного тетрамера.
Конкатемерные конструкции Kir 1.1a были созданы в четыре этапа.(a) Три отдельные молчащие мутации были сконструированы в Kir 1. 1a для создания уникальных сайтов рестрикции. Два из этих сайтов, RsrII и KasI, были введены на 5′-конце ORF, а другой, Bpu1102I, был помещен на 3′-конец. Уникальные 5′-сайты были также введены в мутант Kir 1.1a 331X. (b) Два разных линкерных олигонуклеотида независимо лигировали с уникальным 3′-сайтом рестрикции. Линкер-1 кодировал 3′-конец Kir 1.1a от сайта Bpu1102I (охватывающий последние 14 аминокислот Kir 1.1a), кодоны для 10 глутаминов и 5′-ORF Kir 1.1a, содержащего уникальный сайт KasI. Линкер-2 был идентичен первому линкеру, за исключением того, что он содержал уникальный сайт RsrII вместо KasI. (c) Три различных димера были сконструированы путем связывания модифицированных мономеров вместе с использованием уникального сайта KasI. Один димер содержал две субъединицы Kir 1.1a с линкером-2, прикрепленным к 3′-концу ORF. Второй димер содержал сайт RsrII на 5′-конце ORF, но не содержал 3′-линкера. Третий димер был идентичен второму, за исключением того, что 3′-субъединица кодировала мутант Kir 1.
1a для создания уникальных сайтов рестрикции. Два из этих сайтов, RsrII и KasI, были введены на 5′-конце ORF, а другой, Bpu1102I, был помещен на 3′-конец. Уникальные 5′-сайты были также введены в мутант Kir 1.1a 331X. (b) Два разных линкерных олигонуклеотида независимо лигировали с уникальным 3′-сайтом рестрикции. Линкер-1 кодировал 3′-конец Kir 1.1a от сайта Bpu1102I (охватывающий последние 14 аминокислот Kir 1.1a), кодоны для 10 глутаминов и 5′-ORF Kir 1.1a, содержащего уникальный сайт KasI. Линкер-2 был идентичен первому линкеру, за исключением того, что он содержал уникальный сайт RsrII вместо KasI. (c) Три различных димера были сконструированы путем связывания модифицированных мономеров вместе с использованием уникального сайта KasI. Один димер содержал две субъединицы Kir 1.1a с линкером-2, прикрепленным к 3′-концу ORF. Второй димер содержал сайт RsrII на 5′-конце ORF, но не содержал 3′-линкера. Третий димер был идентичен второму, за исключением того, что 3′-субъединица кодировала мутант Kir 1. 1а 331Х. (d) Для создания тетрамерных конкатемеров димеры были связаны вместе с использованием уникального сайта RsrII. Один конкатемер содержал четыре субъединицы дикого типа, искусственно связанные вместе (4wt), в то время как другой содержал три субъединицы дикого типа, лигированные с одним мутантом (3wt + 1mut).
1а 331Х. (d) Для создания тетрамерных конкатемеров димеры были связаны вместе с использованием уникального сайта RsrII. Один конкатемер содержал четыре субъединицы дикого типа, искусственно связанные вместе (4wt), в то время как другой содержал три субъединицы дикого типа, лигированные с одним мутантом (3wt + 1mut).
Для создания третьего конкатемера (1mut + 3wt) был принят аналогичный пошаговый подход. (a) Молчащая мутация, содержащая сайт NspV, была введена в Kir 1.1a в кодонах аминокислот 331–332. (b) Линкер-3, кодирующий уникальный сайт NspV, остаток 331 Kir 1.1a, кодоны для 10 глутаминов и 5′-ORF Kir 1.1a, содержащего уникальный сайт KasI, лигировали с уникальным сайтом рестрикции NspV. (c) Димер получали путем лигирования модифицированного мономера Kir 1.1a, содержащего линкер-2 (как указано выше), с конструкцией, содержащей линкер-3, с использованием уникального сайта KasI. (d) Два димера были соединены, как и раньше, с образованием тетрамерного конкатемера с Kir 1.1a 331X в крайнем 5′-положении в ORF, за которым следовали три субъединицы дикого типа (1mut + 3wt).
Последовательность каждого модифицированного мономера подтверждали секвенированием ДНК терминации красителя.Соответствующая тетрамерная конструкция была подтверждена анализом рестрикционных ферментов. Более того, транскрипция in vitro с каждой конкатемерной матрицы кДНК давала транскрипты кРНК правильного размера.
Конструирование слитых белков с зеленым флуоресцентным белком
Для оценки клеточного распределения Kir 1.1a и Kir 1.1a 331X ORF усиленного зеленого флуоресцентного белка (EGFP; Clontech) лигировали в рамке с 5′-концом открытая рамка считывания Kir 1.1a или Kir 1.1а 331Х. EGFP (GFPmut1) представляет собой мутированную форму белка Aequoria victoriae , GFP, который содержит две аминокислотные замены в хромофорной области (F64L и S65T) и использует предпочтительные человеческие кодоны. Он показывает одиночные пики возбуждения и испускания при 490 и 509 нм, соответственно, флуоресцируя в 35 раз более интенсивно, чем GFP дикого типа при возбуждении на 488 нм (Cormack et al. 1996). EGFP был субклонирован в модифицированный pSD64 для использования в качестве цитозольного маркера.
1996). EGFP был субклонирован в модифицированный pSD64 для использования в качестве цитозольного маркера.
Синтез кРНК
Комплементарную РНК транскрибировали in vitro в присутствии кэпирующего аналога G (5 ‘) ppp (5’) G с использованием линеаризованных матриц кДНК PstI или SmaI.Во всех реакциях использовали РНК-полимеразу SP6 (mMESSAGE mMACHINE; Ambion Inc.). После обработки DNaseI кРНК очищали экстракцией фенол-хлороформ и осаждением ацетатом аммония / изопропанолом. Выход и концентрацию измеряли спектрофотометрически и подтверждали электрофорезом в агарозном геле.
Выделение и инъекция ооцитов
Самки Xenopus laevis лягушки были получены от NASCO. Стандартные протоколы были соблюдены для изоляции и ухода за X . laevis ооцитов. Вкратце, лягушек анестезировали погружением в 0,15% 3-аминобензоат и выполняли частичную овариэктомию через разрез брюшной полости. Агрегаты ооцитов вручную вырезали из долей яичника, а затем инкубировали в среде ORII без кальция (82,5 мМ NaCl, 2 мМ KCl, 1 мМ MgCl2 и 5 мМ HEPES), содержащей коллагеназу (тип IA, 2 мг / мл; Sigma Chemical Co. ) в течение ~ 2 ч при комнатной температуре, чтобы удалить фолликулярный слой. После того, как ооциты были тщательно промыты ORII, не содержащим коллагеназы, их поместили в модифицированную среду L15 (50% среда Лейбовица, 10 мМ HEPES, pH 7.4) и хранили при 19 ° C. Через 12–24 ч после выделения здоровые на вид ооциты Дюмона на стадии V – VI пневматически инъецировали (пиковый насос PV820; World Precision Instruments, Inc.) 50 нл воды, содержащей 0–50 нг кРНК, и затем хранили в среде L15 при 19 ° С. Активность канала оценивали через 2-6 дней после инъекции.
) в течение ~ 2 ч при комнатной температуре, чтобы удалить фолликулярный слой. После того, как ооциты были тщательно промыты ORII, не содержащим коллагеназы, их поместили в модифицированную среду L15 (50% среда Лейбовица, 10 мМ HEPES, pH 7.4) и хранили при 19 ° C. Через 12–24 ч после выделения здоровые на вид ооциты Дюмона на стадии V – VI пневматически инъецировали (пиковый насос PV820; World Precision Instruments, Inc.) 50 нл воды, содержащей 0–50 нг кРНК, и затем хранили в среде L15 при 19 ° С. Активность канала оценивали через 2-6 дней после инъекции.
Конфокальная микроскопия и анализ изображений
Конфокальная микроскопия с лазерным сканированием использовалась для определения клеточной локализации EGFP-Kir 1.1a и EGFP-Kir 1.1a 331X. Целые нефиксированные ооциты, погруженные в раствор ORII, визуализировали через объектив APOCHROMAT 10 × (NA = 0.45; Carl Zeiss, Inc.) с использованием микроскопа LSM410 (возбуждение линией 488 нм ионного лазера Omnichrome series 643 Kr / Ar; Carl Zeiss, Inc. ). Флуоресцентное излучение пропускалось через фильтр с длиной волны 515 нм. Фоновая автофлуоресценция, проявляемая неинъектированными ооцитами, была откалибрована до нуля путем регулировки яркости и контрастности при постоянном размере точечного отверстия. Эти настройки сохранялись на протяжении всего курса обучения. Флуоресценцию, ограниченную плазматической мембраной, количественно оценивали в экваториальных фокальных срезах ооцитов с использованием программного обеспечения Image (Национальные институты здравоохранения).Среднюю интенсивность пикселей плазмалеммы определяли для непрерывных линейных сегментов фиксированной ширины (~ 3 мкм), проведенных по всей окружности ооцита. Для всех изображений интенсивность пикселей находилась в пределах линейного диапазона, что было оценено с помощью анализа гистограммы для каждой дозы кРНК. По крайней мере, шесть клеток от двух доноров анализировали на четыре-пять инъекционных доз кРНК.
). Флуоресцентное излучение пропускалось через фильтр с длиной волны 515 нм. Фоновая автофлуоресценция, проявляемая неинъектированными ооцитами, была откалибрована до нуля путем регулировки яркости и контрастности при постоянном размере точечного отверстия. Эти настройки сохранялись на протяжении всего курса обучения. Флуоресценцию, ограниченную плазматической мембраной, количественно оценивали в экваториальных фокальных срезах ооцитов с использованием программного обеспечения Image (Национальные институты здравоохранения).Среднюю интенсивность пикселей плазмалеммы определяли для непрерывных линейных сегментов фиксированной ширины (~ 3 мкм), проведенных по всей окружности ооцита. Для всех изображений интенсивность пикселей находилась в пределах линейного диапазона, что было оценено с помощью анализа гистограммы для каждой дозы кРНК. По крайней мере, шесть клеток от двух доноров анализировали на четыре-пять инъекционных доз кРНК.
Электрофизиология
Токи цельноклеточных ооцитов контролировали с использованием двухмикроэлектродного зажима напряжения, снабженного схемой зажима для ванны (OC-725B; Warner Instruments), как описано ранее (Welling 1997). Вкратце, ооциты помещали в небольшую камеру Lucite и инкубировали в 5 К [5 мМ KCl, 85 мМ N -метил-d-глюкамин (NMDG) –Cl, 1 мМ MgCl 2 , 1 мМ CaCl. 2 , 5 мМ HEPES, pH 7,4] или 45 К (45 мМ KCl, 45 мМ NMDG-Cl, 1 мМ MgCl 2 , 1 мМ CaCl 2 , 5 мМ HEPES, pH 7,4) искусственный раствор. При необходимости добавляли ацетат бария до концентрации 1 мМ. Электроды измерения напряжения и подачи тока имели сопротивление 0,5–1,5 МОм при обратном заполнении 3 M KCl.После достижения стабильного протыкания, когда оба электрода измеряли одинаковый мембранный потенциал, были проведены протоколы импульсов. Стимуляцию и сбор данных выполняли на компьютере Macintosh Centris 650 с использованием аналого-цифрового, цифро-аналогового преобразователя ITC16 (Instrutech Corp.) и программного обеспечения Pulse (HEKA Electronik). Данные были отфильтрованы с частотой 1 кГц и оцифрованы с частотой 2 кГц на жесткий диск с использованием Pulse и IGOR (WaveMetrics, Inc.
Вкратце, ооциты помещали в небольшую камеру Lucite и инкубировали в 5 К [5 мМ KCl, 85 мМ N -метил-d-глюкамин (NMDG) –Cl, 1 мМ MgCl 2 , 1 мМ CaCl. 2 , 5 мМ HEPES, pH 7,4] или 45 К (45 мМ KCl, 45 мМ NMDG-Cl, 1 мМ MgCl 2 , 1 мМ CaCl 2 , 5 мМ HEPES, pH 7,4) искусственный раствор. При необходимости добавляли ацетат бария до концентрации 1 мМ. Электроды измерения напряжения и подачи тока имели сопротивление 0,5–1,5 МОм при обратном заполнении 3 M KCl.После достижения стабильного протыкания, когда оба электрода измеряли одинаковый мембранный потенциал, были проведены протоколы импульсов. Стимуляцию и сбор данных выполняли на компьютере Macintosh Centris 650 с использованием аналого-цифрового, цифро-аналогового преобразователя ITC16 (Instrutech Corp.) и программного обеспечения Pulse (HEKA Electronik). Данные были отфильтрованы с частотой 1 кГц и оцифрованы с частотой 2 кГц на жесткий диск с использованием Pulse и IGOR (WaveMetrics, Inc. ) для последующего анализа.
) для последующего анализа.
Свойства одного канала оценивали через 2–6 дней после инъекции в конфигурации на клетке с помощью метода патч-кламп (Hamill et al.1981). В этих исследованиях желточная мембрана была удалена из ооцитов после гиперосмотического сжатия (Methfessel et al. 1986). Все одноканальные записи выполнялись в симметричных условиях [K + ] (150 мМ KCl, 1 мМ CaCl 2 , 5 мМ HEPES, pH 7,4). Электроды патч-зажим, вытянутые из боросиликатного стекла (7052; Corning-Kovar Corp.), имели сопротивление 1–5 МОм. Одноканальные токи измеряли с помощью усилителя патч-зажима (Axopatch 200A; Axon Instruments), оцифрованного с частотой дискретизации 47 кГц с использованием цифрового записывающего устройства (VR-10B; Instrutech Corp.) и хранится на видеокассете. Данные были получены и проанализированы с использованием программ семейства Acquire и TAC (Bruxton Corp.). Данные воспроизводились, фильтровались восьмиполюсным фильтром Бесселя (900; Frequency Devices Inc. ) с частотой среза 1 кГц и дискретизировались, по крайней мере, в пять раз превышающей частоту фильтрации. Для обнаружения событий использовался критерий порога 50%. Открытые и закрытые гистограммы времени пребывания (логарифмическая шкала времени, 10 интервалов / декаду) были построены из 15–60-секундных записей и соответствовали экспоненциальным распределениям с использованием метода максимального правдоподобия (Sigworth and Sine 1987).Величина тока в одном канале оценивалась путем подгонки гауссовых распределений к гистограммам амплитуды тока или путем измерения амплитуд непосредственно по аналоговым трассам тока. Внутренняя наклонная проводимость была оценена по таким измерениям тока от -120 до -40 мВ.
) с частотой среза 1 кГц и дискретизировались, по крайней мере, в пять раз превышающей частоту фильтрации. Для обнаружения событий использовался критерий порога 50%. Открытые и закрытые гистограммы времени пребывания (логарифмическая шкала времени, 10 интервалов / декаду) были построены из 15–60-секундных записей и соответствовали экспоненциальным распределениям с использованием метода максимального правдоподобия (Sigworth and Sine 1987).Величина тока в одном канале оценивалась путем подгонки гауссовых распределений к гистограммам амплитуды тока или путем измерения амплитуд непосредственно по аналоговым трассам тока. Внутренняя наклонная проводимость была оценена по таким измерениям тока от -120 до -40 мВ.
Анализ данных
Kir 1.1a и Kir 1.1a 331X эксперименты с коэкспрессией были проанализированы с использованием биномиальной теории вероятностей, как впервые было описано для каналов K + с потенциометром Mackinnon 1991.Предполагая, что мутантные (mut) субъединицы и субъединицы дикого типа коэкспрессируются с одинаковой эффективностью и случайным образом собираются в комплекс, содержащий n субъединиц, биномиальная теория предсказывает, что ( n + 1) разные популяции каналов будут сформированы с конечными вероятностями, которые предписано относительными количествами двух субъединиц [F mut = нанограммы mut кРНК / (нанограммы mut кРНК + нанограммы wt кРНК)]. Первоначально были рассмотрены два идеальных случая. Для этих моделей также предполагалось, что субъединицы дикого типа и мутантные субъединицы олигомеризуются с одинаковой эффективностью и что любая популяция каналов либо полностью активна, либо полностью ингибируется.В случае полного доминантно-отрицательного эффекта в тетрамерном канале популяция активных каналов будет описываться вероятностью образования каналов, которые состоят исключительно из субъединиц дикого типа, или (1 — F mut ) 4 . Для отрицательного эффекта, требующего наличия двух мутантов в тетрамере, популяция активных каналов будет описываться вероятностью образования каналов, которые имеют менее двух мутантных субъединиц, или (1 — F mut ) 4 + 4 F mut (1 — F mut ) 3 .
Первоначально были рассмотрены два идеальных случая. Для этих моделей также предполагалось, что субъединицы дикого типа и мутантные субъединицы олигомеризуются с одинаковой эффективностью и что любая популяция каналов либо полностью активна, либо полностью ингибируется.В случае полного доминантно-отрицательного эффекта в тетрамерном канале популяция активных каналов будет описываться вероятностью образования каналов, которые состоят исключительно из субъединиц дикого типа, или (1 — F mut ) 4 . Для отрицательного эффекта, требующего наличия двух мутантов в тетрамере, популяция активных каналов будет описываться вероятностью образования каналов, которые имеют менее двух мутантных субъединиц, или (1 — F mut ) 4 + 4 F mut (1 — F mut ) 3 .
После рассмотрения этих двух возможностей, модифицированное уравнение вероятности, I / I o = (1- k F mut ) 4 , был разработан для описания доминирующего отрицательного эффекта Kir 1. 1a 331X. Эта модель поддерживает фундаментальные свойства биномиального распределения (то есть случайную сборку n субъединиц, определяемую F mut ), но учитывает отклонения в эффективности олигомеризации мутантных каналов или частичное текущее ингибирование одной мутантной субъединицей.Аппроксимация кривой для анализа доминирующего отрицательного эффекта была проведена с использованием IGOR. Поправочный коэффициент, k , был получен путем подбора нормированного макроскопического тока ( I / I o ) как функцию F mut с модифицированным уравнением вероятности с использованием нелинейного итеративного алгоритма наименьших квадратов (Levenberg-Marquardt).
1a 331X. Эта модель поддерживает фундаментальные свойства биномиального распределения (то есть случайную сборку n субъединиц, определяемую F mut ), но учитывает отклонения в эффективности олигомеризации мутантных каналов или частичное текущее ингибирование одной мутантной субъединицей.Аппроксимация кривой для анализа доминирующего отрицательного эффекта была проведена с использованием IGOR. Поправочный коэффициент, k , был получен путем подбора нормированного макроскопического тока ( I / I o ) как функцию F mut с модифицированным уравнением вероятности с использованием нелинейного итеративного алгоритма наименьших квадратов (Levenberg-Marquardt).
Статистическая оценка всех данных была выполнена с помощью статистического пакета GB-Stat ™ v 5.0.6 для Macintosh (Dynamic Microsystems, Inc.). Где применимо, для сравнения тестовых групп использовался объединенный тест Стьюдента t . Все данные представлены как среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ
Делеция последних 60 аминокислот в Kir 1.1a устраняет активность канала
В качестве первого подхода к изучению функциональных последствий усечения COOH-конца, кРНК 331X Kir 1.1a и Kir 1.1a были независимо друг от друга. вводили в ооциты Xenopus , и макроскопические токи измеряли с помощью двухмикроэлектродных зажимов напряжения.Как и было предсказано из связи с синдромом Барттера, усечение крайнего конца COOH Kir 1.1a отменяет активность канала (). Ооциты, инъецированные с помощью кРНК Kir 1.1a, экспрессируют большие, слабо выпрямляющие внутрь макроскопические токи, типичные для канала дикого типа (Ho et al. 1993). Напротив, в ооцитах, инъецированных кРНК Kir 1.1a 331X, токи выше фона не обнаруживаются. Средний макроскопический ток, чувствительный к Ba 2+ , при -90 мВ составлял -0,11 ± 0,05 мкА ( n = 6) по сравнению с -17.95 ± 2,87 мкА ( n = 12) для канала дикого типа. В соответствии с макроскопическими данными в ооцитах, инъецированных мутантной кРНК, не было обнаружено никакой значительной активности, за исключением случайных открытий каналов, активируемых эндогенным растяжением (Yang and Sachs, 1990) (см. C, n = 12).
C, n = 12).
Усечение аминокислот 332–391 (Kir 1.1a 331X) нарушает функциональную экспрессию канала Kir 1.1a. (A) Типичные семейства токов целых клеток и (B) макроскопические вольт-амперные отношения, измеренные для ооцитов Xenopus , инъецированных либо Kir 1.1a (•) или Kir 1.1a 331X (▪) кРНК (250 пг) с использованием двухмикроэлектродного зажима напряжения. Токи вызывались фиксирующими импульсами напряжения длительностью 500 мс от -150 до +50 мВ с шагом 20 мВ (V HOLD = 0 мВ; [K + ] o = 45 мМ). Этот импульсный протокол использовался во всех последующих измерениях макроскопической активности канала, если не указано иное.
Полный доминирующий негативный эффект одного Kir 1.1a 331X подтвержден в одноканальных записях. Одноканальные записи и соответствующие гистограммы амплитуд по всем точкам были получены в режиме прикрепления клеток при V m = -80 мВ от ооцитов, инъецированных либо (A) wt Kir 1.1a, (B) 4wt конкатенированный тетрамер, (C) Kir 1. 1a 331X, или (D) 3wt + 1mut конкатенированный тетрамер. Случайные события канала с низкой проводимостью могут быть обнаружены в некоторых записях ооцитов, инъецированных мутантной или содержащей мутант конкатемером кРНК. Они, вероятно, не отражают функцию мутантных каналов, поскольку аналогичные события могут быть обнаружены в неинъектированных ооцитах. Идентичные результаты были получены для обоих конкатемеров, содержащих мутант (1mut + 3wt, не показаны).
1a 331X, или (D) 3wt + 1mut конкатенированный тетрамер. Случайные события канала с низкой проводимостью могут быть обнаружены в некоторых записях ооцитов, инъецированных мутантной или содержащей мутант конкатемером кРНК. Они, вероятно, не отражают функцию мутантных каналов, поскольку аналогичные события могут быть обнаружены в неинъектированных ооцитах. Идентичные результаты были получены для обоих конкатемеров, содержащих мутант (1mut + 3wt, не показаны).
Для определения функции Kir 1.1a COOH-концевого домена, мы выяснили механизм, вызывающий дефект в этом конкретном мутанте Барттера. Очевидно, что величина макроскопического тока Kir 1.1a является произведением количества каналов в мембране, вероятности открытия канала и проводимости отдельного канала. Усечение крайних COOH-концевых 60 аминокислот Kir 1.1a может аннулировать активность канала за счет снижения любого из этих количеств, отдельно или в комбинации. Число каналов в мембране может быть уменьшено из-за глобального структурного изменения, потери существенного домена олигомеризации или нарушения мембранного транспорта или стабильности плазматической мембраны. Альтернативно, мутантные каналы могут экспрессироваться в плазматической мембране в непроводящей или нефункциональной конформации. Потенциальные механизмы, лежащие в основе дефекта Kir 1.1a 331X, предполагают разные функциональные роли крайнего COOH-терминального домена, поэтому мы исследовали каждый.
Альтернативно, мутантные каналы могут экспрессироваться в плазматической мембране в непроводящей или нефункциональной конформации. Потенциальные механизмы, лежащие в основе дефекта Kir 1.1a 331X, предполагают разные функциональные роли крайнего COOH-терминального домена, поэтому мы исследовали каждый.
Каналы мутанта могут олигомеризоваться с помощью субъединиц дикого типа
Дефект олигомеризации или глобальная структурная мутация могут быть легко протестированы путем совместной экспрессии мутанта с каналом дикого типа.Если мутантный белок синтезирован, правильно свернут и способен к олигомеризации, макроскопический ток в ооцитах, совместно инъецированных с кРНК дикого типа и мутантной, будет меньше, чем в ооцитах, инъецированных только диким типом. B обобщает результаты такого исследования. Коэкспрессия Kir 1.1a 331X с каналом дикого типа снижает чувствительный к Ba 2+ макроскопический ток на 62 ± 5%, демонстрируя, что мутант способен оказывать негативное влияние на канал дикого типа ( n = 12, Кир 1. 1а 331Х; n = 18, Кир 1.1a; P <0,005).
1а 331Х; n = 18, Кир 1.1a; P <0,005).
Делеция крайнего конца COOH не вызывает глобальную структурную мутацию и не препятствует олигомеризации субъединицы. (A) Репрезентативные семейства целых клеточных токов, записанные из ооцитов, инъецированных кРНК Kir 1.1a (250 пг) или Kir 1.1a и Kir 1.1a 331X (250 пг каждая). (B) Ва 2+ -чувствительные макроскопические токи (V m = -90 мВ), измеренные в ооцитах, совместно инъецированных с эквивалентными количествами кРНК, кодирующей Kir 1.1a и Kir 1.1 331X или Kir 1.1a и Kir 3.1-AAA (250 пг каждый), нормализованные к среднему току контрольной группы, инъецированной только Kir 1.1a (250 пг) (* P <0,005). Kir 3.1-AAA представляет собой мутантную непроводящую форму канала Kir, закрываемого G-белком, который оказывает доминирующий негативный эффект на Kir 3.1, но не олигомеризуется с Kir 1.1a.
Чтобы гарантировать, что эффект Kir 1.1a 331X является специфическим и не связан с конкуренцией мутантной кРНК за аппарат трансляции, эксперимент был повторен с неродственным доминантным отрицательным каналом Kir, Kir 3. 1-ААА. Kir 3.1 был сделан непроводящим путем замены ключевой Gly-Tyr-Gly K + -селективной последовательности (аминокислоты 145–147) тремя остатками Ala (Tinker et al. 1996). Kir 3.1, блокируемый G белком канал Kir, как полагают, не олигомеризуется с Kir 1.1a. Как показано на B, Kir 3.1-AAA не оказывает влияния на экспрессию Kir 1.1a. Этот результат указывает на то, что трансляция кРНК Kir 1.1a не ингибируется при совместной инъекции второго транскрипта. Вместо этого преобладающий негативный эффект Кир 1.1a 331X обусловлен олигомеризацией мутантных субъединиц и субъединиц дикого типа.
1-ААА. Kir 3.1 был сделан непроводящим путем замены ключевой Gly-Tyr-Gly K + -селективной последовательности (аминокислоты 145–147) тремя остатками Ala (Tinker et al. 1996). Kir 3.1, блокируемый G белком канал Kir, как полагают, не олигомеризуется с Kir 1.1a. Как показано на B, Kir 3.1-AAA не оказывает влияния на экспрессию Kir 1.1a. Этот результат указывает на то, что трансляция кРНК Kir 1.1a не ингибируется при совместной инъекции второго транскрипта. Вместо этого преобладающий негативный эффект Кир 1.1a 331X обусловлен олигомеризацией мутантных субъединиц и субъединиц дикого типа.
Чтобы получить более полное представление о доминантно-негативном механизме, возрастающие дозы мутантной кРНК вводили одновременно с постоянным количеством транскрипта дикого типа (; n = 5–14 каждая доза). Поскольку каналы Kir 1.1a, как известно, являются тетрамерными по структуре (Glowatzki et al. 1995), совместная инъекция д. Давать пять дискретных популяций, содержащих от нуля до четырех мутантных субъединиц. Предполагая случайную сборку, биномиальное распределение вероятностей, определяемое двумя параметрами, F mut и n , определяет вероятность получения каждой совокупности каналов.F mut , мутантная фракция общей введенной кРНК [F mut = нанограммы mut кРНК / (нанограммы mut кРНК + нанограммы wt кРНК)], представляет собой вероятность включения субъединицы Kir 1.1a 331X. Для тетрамерного канала количество субъединиц, n, равно 4. Относительная частота функциональных популяций определяет результирующую макроскопическую плотность тока. Прогнозируемые отношения для двух конкретных доминирующих отрицательных моделей показаны на. Рассмотрим ситуацию, когда включение одной или нескольких мутантных субъединиц отменяет активность канала.Относительный ток определяется вероятностью сборки четырех субъединиц дикого типа в тетрамер. В этом случае макроскопический ток можно предсказать с помощью соотношения: I / I o = (1 — F mut ) 4 (, строка A).
Предполагая случайную сборку, биномиальное распределение вероятностей, определяемое двумя параметрами, F mut и n , определяет вероятность получения каждой совокупности каналов.F mut , мутантная фракция общей введенной кРНК [F mut = нанограммы mut кРНК / (нанограммы mut кРНК + нанограммы wt кРНК)], представляет собой вероятность включения субъединицы Kir 1.1a 331X. Для тетрамерного канала количество субъединиц, n, равно 4. Относительная частота функциональных популяций определяет результирующую макроскопическую плотность тока. Прогнозируемые отношения для двух конкретных доминирующих отрицательных моделей показаны на. Рассмотрим ситуацию, когда включение одной или нескольких мутантных субъединиц отменяет активность канала.Относительный ток определяется вероятностью сборки четырех субъединиц дикого типа в тетрамер. В этом случае макроскопический ток можно предсказать с помощью соотношения: I / I o = (1 — F mut ) 4 (, строка A). Если два или более мутантов должны быть включены в тетрамер для ингибирования активности канала, дополнительный термин, вероятность образования канала с одним мутантом и тремя субъединицами дикого типа [4 F mut (1 — F mut ) 3 ], добавляется к уравнению выше (строка B).
Если два или более мутантов должны быть включены в тетрамер для ингибирования активности канала, дополнительный термин, вероятность образования канала с одним мутантом и тремя субъединицами дикого типа [4 F mut (1 — F mut ) 3 ], добавляется к уравнению выше (строка B).
Доминирующие негативные эффекты Кир 1.1a 331X на Кир 1.1a дикого типа. Ba 2+ -чувствительный входящий ток нанесен ( I / I o , V m = -90 мВ) в зависимости от F mut , мутантной фракции общей введенной кРНК [F mut = нанограммы mut кРНК / (нанограммы mut кРНК + нанограммы wt кРНК)] . F mut был скорректирован путем одновременного введения различных количеств Kir 1.1a 331X с постоянной дозой Kir 1.1a (250 пг) и I . o — средний ток, когда F mut = 0.Пунктирная линия (A) представляет предполагаемую взаимосвязь, если включение одной или нескольких мутантных субъединиц в тетрамер подавляет функцию канала [ I / I o = (1 F mut ) 4 ]. Пунктирная кривая (B) прогнозируется, если требуются две или более субъединиц [ I / I o = (1 — F mut ) 4 + 4 (1 — F mut ) 3 F mut ]. Данные лучше всего подходят для промежуточной модели, I / I o = (1-0.6 F mut ) 4 , представленный сплошной линией (C). Коэффициент k меньше единицы, что указывает на то, что одна мутантная субъединица частично ингибирует ток или что Kir 1.1a331X олигомеризуется с пониженной эффективностью.
Пунктирная кривая (B) прогнозируется, если требуются две или более субъединиц [ I / I o = (1 — F mut ) 4 + 4 (1 — F mut ) 3 F mut ]. Данные лучше всего подходят для промежуточной модели, I / I o = (1-0.6 F mut ) 4 , представленный сплошной линией (C). Коэффициент k меньше единицы, что указывает на то, что одна мутантная субъединица частично ингибирует ток или что Kir 1.1a331X олигомеризуется с пониженной эффективностью.
Как показано на, ни одна идеальная модель не может адекватно описать доминирующий негативный эффект Kir 1.1a 331X. Вместо этого, чтобы охарактеризовать этот конкретный доминантно-отрицательный мутант, данные были подогнаны к модифицированному уравнению вероятности: I / I o = (1- k F mut ) 4 , где коэффициент, k , является поправочным коэффициентом, который может учитывать изменения в эффективности олигомеризации или частичное подавление тока. Промежуточная модель (линия C) требовала фактора k , равного 0,6, для точного описания данных, предполагая, что Kir 1.1a 331X имеет пониженную эффективность олигомеризации (~ 60% по сравнению с диким типом) или что одна мутантная субъединица только частично ингибирует активность канала. В первом случае вероятность включения мутанта ниже, чем прогнозировалось из соотношения введенных кРНК. В последнем случае измеренное значение I / I o отражает не только популяцию дикого типа, но также относительную частоту каналов, которые содержат мутант и несут пониженный ток.Поскольку две возможности имеют разные последствия для функции крайнего COOH-концевого домена, источник промежуточной модели был решен с помощью эксперимента, описанного ниже.
Промежуточная модель (линия C) требовала фактора k , равного 0,6, для точного описания данных, предполагая, что Kir 1.1a 331X имеет пониженную эффективность олигомеризации (~ 60% по сравнению с диким типом) или что одна мутантная субъединица только частично ингибирует активность канала. В первом случае вероятность включения мутанта ниже, чем прогнозировалось из соотношения введенных кРНК. В последнем случае измеренное значение I / I o отражает не только популяцию дикого типа, но также относительную частоту каналов, которые содержат мутант и несут пониженный ток.Поскольку две возможности имеют разные последствия для функции крайнего COOH-концевого домена, источник промежуточной модели был решен с помощью эксперимента, описанного ниже.
Промежуточная доминантно-отрицательная модель обусловлена пониженной эффективностью олигомеризации
Чтобы критически проверить эффекты включения одного мутанта в канал Kir 1.1a и определить происхождение промежуточной модели, три различных тетрамерных конкатемерных кДНК (4wt, 3wt + 1mut и 1mut + 3wt). Создав тандемные конкатемеры, можно оценить функциональные последствия включения одной мутантной субъединицы в тетрамерный канал способом, который не зависит от эффективности олигомеризации. Как описано в методах, четыре мономерных кДНК Kir 1.1a были искусственно связаны вместе с кодонами для 10 остатков глутамина. Глютаминовые линкеры успешно использовались в предыдущих исследованиях для связывания субъединиц калиевых каналов вместе (Yang et al. 1995b) и, как полагают, обладают небольшой вторичной структурой и оказывают минимальное влияние на функцию каналов.Как показано в, мы подтвердили этот подход, изучив функциональные характеристики 4wt и влияние мономеров Kir 1.1a 331X на конкатенированные каналы.
Создав тандемные конкатемеры, можно оценить функциональные последствия включения одной мутантной субъединицы в тетрамерный канал способом, который не зависит от эффективности олигомеризации. Как описано в методах, четыре мономерных кДНК Kir 1.1a были искусственно связаны вместе с кодонами для 10 остатков глутамина. Глютаминовые линкеры успешно использовались в предыдущих исследованиях для связывания субъединиц калиевых каналов вместе (Yang et al. 1995b) и, как полагают, обладают небольшой вторичной структурой и оказывают минимальное влияние на функцию каналов.Как показано в, мы подтвердили этот подход, изучив функциональные характеристики 4wt и влияние мономеров Kir 1.1a 331X на конкатенированные каналы.
Тандемное ковалентное связывание четырех субъединиц Kir 1.1a дикого типа ограничивает стехиометрию канала без изменения биофизических свойств. (A) Каналы Kir 1.1a дикого типа были выражены либо в виде мономеров (вес Kir 1.1a), либо в виде конкатемеров (4wt), где четыре субъединицы были ковалентно связаны между собой через линкер из 10 остатков глутамина (см. Текст для Детали).(B) Ооциты, инъецированные кРНК, кодирующей либо Kir 1.1a дикого типа (▪), либо конкатемер 4wt (□), проявляли слабые выпрямляющие внутрь макроскопические токи, которые блокировались зависимым от напряжения образом Ba 2+ (не показано). Показаны токи, нормированные на среднюю амплитуду при -150 мВ ( I / I o ) в зависимости от напряжения. (C) Нет доминирующего отрицательного эффекта мономеров Kir 1.1a 331X на конкатемерные тетрамеры, подтверждая, что каналы 4wt состоят из одного тетрамерного белка.Показаны токи (V m = -90 мВ), измеренные в ооцитах, совместно инъецированных конкатемером 4wt и Kir 1.1a 331X, нормализованные к среднему току в контрольной группе, коинъекции которого вводили конкатемером 4wt и неродственной кРНК, CD4. Репрезентативные одноканальные записи прикрепленных к клеткам ооцитов, инъецированных либо (D) Kir 1.1a дикого типа, либо (E) конкатемером кРНК 4wt (вверху слева, V m = -80 мВ).
Текст для Детали).(B) Ооциты, инъецированные кРНК, кодирующей либо Kir 1.1a дикого типа (▪), либо конкатемер 4wt (□), проявляли слабые выпрямляющие внутрь макроскопические токи, которые блокировались зависимым от напряжения образом Ba 2+ (не показано). Показаны токи, нормированные на среднюю амплитуду при -150 мВ ( I / I o ) в зависимости от напряжения. (C) Нет доминирующего отрицательного эффекта мономеров Kir 1.1a 331X на конкатемерные тетрамеры, подтверждая, что каналы 4wt состоят из одного тетрамерного белка.Показаны токи (V m = -90 мВ), измеренные в ооцитах, совместно инъецированных конкатемером 4wt и Kir 1.1a 331X, нормализованные к среднему току в контрольной группе, коинъекции которого вводили конкатемером 4wt и неродственной кРНК, CD4. Репрезентативные одноканальные записи прикрепленных к клеткам ооцитов, инъецированных либо (D) Kir 1.1a дикого типа, либо (E) конкатемером кРНК 4wt (вверху слева, V m = -80 мВ). Входящие токи исследуются, поэтому отклонения вверх представляют собой закрытие канала.Для каждой из них показаны гистограммы времени выдержки между током и напряжением (внизу слева), разомкнутой (вверху справа) и замкнутой (внизу справа). Проводимость одного канала дикого типа и конкатемерного канала идентичны. Сплошная линия на каждой гистограмме времени пребывания представляет логарифмическое соответствие экспериментальным данным. Кинетика обоих каналов лучше всего описывалась единичным временем открытия и закрытия, хотя на некоторых участках более длительное (τ = 20 мс) закрытое состояние, как описано Choe et al.В 1998 г. на долю закрытий каналов приходилось <0,5%. Как каналы дикого типа, так и конкатемерные каналы показали высокую вероятность открытия (0,93 ± 0,01 против 0,94 ± 0,004, соответственно).
Входящие токи исследуются, поэтому отклонения вверх представляют собой закрытие канала.Для каждой из них показаны гистограммы времени выдержки между током и напряжением (внизу слева), разомкнутой (вверху справа) и замкнутой (внизу справа). Проводимость одного канала дикого типа и конкатемерного канала идентичны. Сплошная линия на каждой гистограмме времени пребывания представляет логарифмическое соответствие экспериментальным данным. Кинетика обоих каналов лучше всего описывалась единичным временем открытия и закрытия, хотя на некоторых участках более длительное (τ = 20 мс) закрытое состояние, как описано Choe et al.В 1998 г. на долю закрытий каналов приходилось <0,5%. Как каналы дикого типа, так и конкатемерные каналы показали высокую вероятность открытия (0,93 ± 0,01 против 0,94 ± 0,004, соответственно).
Чтобы подтвердить, что ковалентное связывание субъединиц не нарушает структуру или функцию канала, мы сравнили биофизические свойства дикого типа и конкатенированного Kir 1.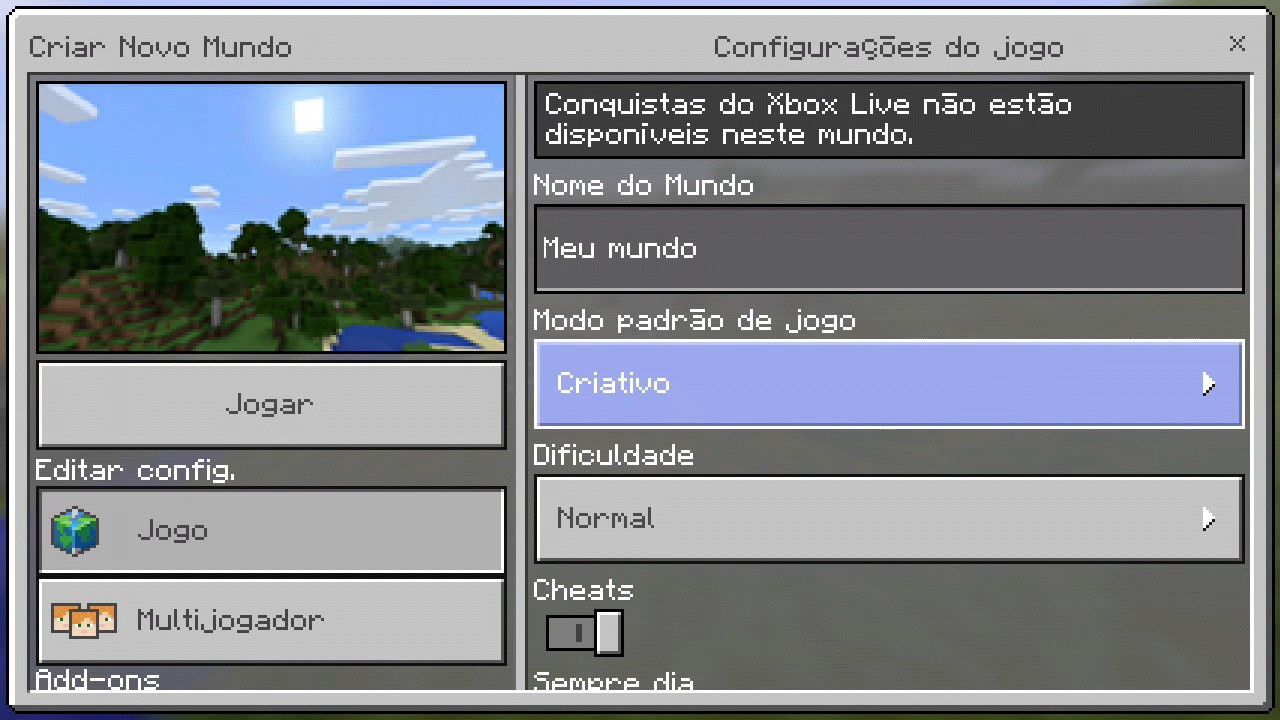 1a. Инъекция 4w тандемной кРНК тетрамера ( n = 22) в ооциты продуцировала каналы K + , которые проявляли слабую внутреннюю ректификацию и потенциал-зависимую блокировку внеклеточным Ba 2+ (не показано), идентичные Kir 1 дикого типа .1а ( n = 12, В). Более того, ковалентное связывание субъединиц дикого типа не влияло на свойства одного канала ( n = 7 каждый). Эти результаты суммированы в и. Как Kir 1.1a дикого типа, так и конкатемер 4wt имели одинаковую вероятность открытия (0,93 ± 0,01 против 0,94 ± 0,004, соответственно) и одноканальную проводимость (37 ± 2,47 против 39,6 ± 1,26 пСм, соответственно). Подобно каналу дикого типа, кинетика конкатемера лучше всего описывается одиночным открытым (Kir 1.1a, τ o = 20 ± 0.87 мс; 4wt, τ o = 18 ± 1 мс) и время закрытия (Kir 1.1a, τ c = 1,1 ± 0,03 мс; 4wt, τ c = 1,05 ± 0,04 мс). Эти данные ясно демонстрируют, что тандемный тетрамер точно воспроизводит функцию канала дикого типа.
1a. Инъекция 4w тандемной кРНК тетрамера ( n = 22) в ооциты продуцировала каналы K + , которые проявляли слабую внутреннюю ректификацию и потенциал-зависимую блокировку внеклеточным Ba 2+ (не показано), идентичные Kir 1 дикого типа .1а ( n = 12, В). Более того, ковалентное связывание субъединиц дикого типа не влияло на свойства одного канала ( n = 7 каждый). Эти результаты суммированы в и. Как Kir 1.1a дикого типа, так и конкатемер 4wt имели одинаковую вероятность открытия (0,93 ± 0,01 против 0,94 ± 0,004, соответственно) и одноканальную проводимость (37 ± 2,47 против 39,6 ± 1,26 пСм, соответственно). Подобно каналу дикого типа, кинетика конкатемера лучше всего описывается одиночным открытым (Kir 1.1a, τ o = 20 ± 0.87 мс; 4wt, τ o = 18 ± 1 мс) и время закрытия (Kir 1.1a, τ c = 1,1 ± 0,03 мс; 4wt, τ c = 1,05 ± 0,04 мс). Эти данные ясно демонстрируют, что тандемный тетрамер точно воспроизводит функцию канала дикого типа.
Чтобы гарантировать, что четыре конкатенированных субъединицы вносят вклад в формирование канала, конкатемер 4wt коэкспрессируется либо с доминантно-отрицательным Kir 1.1a 331X, либо с неродственным генным продуктом, CD4. Результаты этих исследований обобщены в C.Как и предполагалось, если четыре конкатенированных субъединицы образуют функциональные каналы, на токи конкатемеров 4wt не влияет коэкспрессия доминантно-отрицательного мутанта Kir 1.1a 331X ( n = 11). Эти наблюдения подтверждают, что каналы действительно формируются из одного белка, а не из частей множества конкатемеров.
Продемонстрировав, что конкатенация субъединиц не влияет на функцию канала, мы протестировали функциональные эффекты Kir 1.1a 331X в тандемном тетрамере.Включение одного мутанта в конкатемерный тетрамер либо в NH 2 -, либо в положения COOH (1mut + 3wt или 3wt + 1mut, соответственно) полностью подавляет активность макроскопических каналов. Эти результаты суммированы в. В отличие от конкатемера 4wt (−2,56 ± 0,34 мкА, n = 25), конкатемеры 1mut + 3wt и 3wt + 1mut не показали измеряемых токов выше фона (−0,15 ± 0,03 и −0,10 ± 0,02 мкА, соответственно, n = 12, P <0.0001). Полный доминирующий негативный эффект был подтвержден на одноканальном уровне. За исключением случайных открытий каналов, активируемых эндогенным растяжением на некоторых участках, не удалось обнаружить значительную активность в участках внутри клеток ооцитов, инъецированных каким-либо мутант-содержащим конкатемером (, wt + 1mut, n = 14, общее время записи = 56 мин; 1mut + 3wt, n = 17, общее время записи = 31 мин).
В отличие от конкатемера 4wt (−2,56 ± 0,34 мкА, n = 25), конкатемеры 1mut + 3wt и 3wt + 1mut не показали измеряемых токов выше фона (−0,15 ± 0,03 и −0,10 ± 0,02 мкА, соответственно, n = 12, P <0.0001). Полный доминирующий негативный эффект был подтвержден на одноканальном уровне. За исключением случайных открытий каналов, активируемых эндогенным растяжением на некоторых участках, не удалось обнаружить значительную активность в участках внутри клеток ооцитов, инъецированных каким-либо мутант-содержащим конкатемером (, wt + 1mut, n = 14, общее время записи = 56 мин; 1mut + 3wt, n = 17, общее время записи = 31 мин).
Включение одиночного мутанта Kir 1.1a 331X в NH 2 — или COOH-концевое положение тандемного тетрамера подавляет активность канала.(A) Типичные семейства токов всей клетки, (B) составные вольт-амперные отношения и (C) нормированные макроскопические Ba 2+ -чувствительные токи (V м = -90 мВ), измеренные от ооцитов, инъецированных эквивалентным показаны количества 4wt, 3wt + 1mut или 1mut + 3wt конкатенированной кРНК тетрамера (1 нг; * P <0,0001).
Поскольку Kir 1.1a 331X оказывает полный доминантный негативный эффект, когда он ограничен ковалентной связью конкатенированного тетрамера, ясно, что промежуточная доминантно-негативная модель является результатом снижения эффективности олигомеризации на ~ 40%.Роль крайнего конца COOH в управлении эффективностью сборки субъединиц согласуется как с рецессивной природой болезни Барттера, так и с двумя предыдущими сообщениями, которые вовлекают конец COOH в тетрамеризацию (Tinker et al. 1996; Koster et al. 1998). Хотя этот домен влияет на эффективность олигомеризации Kir 1.1a, эти результаты в совокупности демонстрируют, что укорочение COOH-конца имеет более важные функциональные последствия после сборки канала.
Оба Кир 1.1a и Kir 1.1a 331X экспрессируются на плазматической мембране ооцита
Чтобы проверить роль COOH-концевого домена (аминокислоты 332–391) в определении мембранного переноса и стабильности плазматической мембраны, NH 2 -концевая усиленная зеленая флуоресценция Слитые белки Kir 1. 1a и Kir 1.1a 331X были сконструированы и экспрессированы в ооцитах. Эта стратегия предпочтительнее анализа связывания антител (Firsov et al. 1996), потому что включение внешнего эпитопа (Flag или AUI) устраняет Kir 1.1а функция. Как показано на фиг.4, присоединение EGFP на конце NH 2 не влияло на проводимость одного канала (γ = 39 ± 3 пСм) или кинетику с высокой вероятностью открытия ( P o = 0,91 ± 0,01) Кир 1.1a ( n = 4). Отсутствие EGFP-зависимых функциональных эффектов предлагает убедительные доказательства того, что структура канала не изменяется концевым слитым белком NH 2 .
1a и Kir 1.1a 331X были сконструированы и экспрессированы в ооцитах. Эта стратегия предпочтительнее анализа связывания антител (Firsov et al. 1996), потому что включение внешнего эпитопа (Flag или AUI) устраняет Kir 1.1а функция. Как показано на фиг.4, присоединение EGFP на конце NH 2 не влияло на проводимость одного канала (γ = 39 ± 3 пСм) или кинетику с высокой вероятностью открытия ( P o = 0,91 ± 0,01) Кир 1.1a ( n = 4). Отсутствие EGFP-зависимых функциональных эффектов предлагает убедительные доказательства того, что структура канала не изменяется концевым слитым белком NH 2 .
Слияние EGFP с концом Kir 1.1a NH 2 не изменяет функцию канала.Показаны типичные одноканальные записи (V m = -80 мВ) и соответствующие вольт-амперные отношения, полученные в режиме прикрепления к клеткам из ооцитов, инъецированных кРНК EGFP-Kir 1.1a. EGFP-Kir 1.1a открывается с такой же наклонной проводимостью внутрь (внизу) и вероятностью открытия (0,91 ± 0,01), что и канал дикого типа.
Как показано на фиг. 9, целые нефиксированные ооциты, инъецированные кРНК слитого белка EGFP, исследовали с использованием лазерной сканирующей конфокальной микроскопии. Неинъектированные ооциты проявляли низкую базальную автофлуоресценцию.EGFP был широко распределен по цитоплазме ( n = 6). Напротив, как EGFP-Kir 1.1a, так и EGFP-Kir 1.1a 331X были локализованы вдоль отдельной зоны, ограничивающей ооцит ( n = 6 в каждой дозе инъекции). Круговой узор флуоресценции сохранялся в последовательных оптических срезах в z-плоскости по всему ооциту, что согласуется с преобладающей экспрессией плазматической мембраны. Интенсивность флуоресценции была пропорциональна количеству введенной кРНК гибридного белка, и между EGFP-Kir 1 не было обнаружено значительных различий.1a и EGFP-Kir 1.1a 331X в любой дозе инъекции (B). Эти данные подтверждают предположение, что оба канала экспрессируются на плазматической мембране с одинаковой эффективностью.
Усечение COOH-конца не изменяет трафик Kir 1. 1a или стабильность плазматической мембраны в системе экспрессии ооцитов Xenopus . (A) Типичные оптические срезы, полученные из ооцитов в фокальной плоскости вблизи экватора с использованием конфокальной микроскопии с лазерным сканированием. Ооциты инъецировали EGFP, EGFP-Kir 1.1a или EGFP-Kir 1.КРНК 331X 1a сравнивали с неинъектированными ооцитами. (B) Интенсивность окружной флуоресценции, построенная как функция введенной дозы кРНК гибридного белка. Не было обнаружено значительных различий в распределении и интенсивности периферической флуоресценции при любой дозе инъекции. Сплошная линия представляет собой аппроксимацию линейной регрессии средней окружной флуоресценции для ооцитов, инъецированных кРНК слитого белка дикого типа или мутантного белка. C) Макроскопическую проводимость измеряли в ооцитах, инъецированных любой слитой конструкцией при нескольких инъекционных дозах кРНК, и наносили на график как функцию ограниченной флуоресценции плазматической мембраны.Наклонную проводимость определяли в диапазоне от -110 до -30 мВ для ооцитов, промытых в 5 мМ [K + ] o .
1a или стабильность плазматической мембраны в системе экспрессии ооцитов Xenopus . (A) Типичные оптические срезы, полученные из ооцитов в фокальной плоскости вблизи экватора с использованием конфокальной микроскопии с лазерным сканированием. Ооциты инъецировали EGFP, EGFP-Kir 1.1a или EGFP-Kir 1.КРНК 331X 1a сравнивали с неинъектированными ооцитами. (B) Интенсивность окружной флуоресценции, построенная как функция введенной дозы кРНК гибридного белка. Не было обнаружено значительных различий в распределении и интенсивности периферической флуоресценции при любой дозе инъекции. Сплошная линия представляет собой аппроксимацию линейной регрессии средней окружной флуоресценции для ооцитов, инъецированных кРНК слитого белка дикого типа или мутантного белка. C) Макроскопическую проводимость измеряли в ооцитах, инъецированных любой слитой конструкцией при нескольких инъекционных дозах кРНК, и наносили на график как функцию ограниченной флуоресценции плазматической мембраны.Наклонную проводимость определяли в диапазоне от -110 до -30 мВ для ооцитов, промытых в 5 мМ [K + ] o . В ооцитах, экспрессирующих EGFP-Kir 1.1a 331X, проводимость выше фона не обнаружена, что согласуется с предположением, что Kir 1.1a 331X находится в плазматической мембране, но находится в непроводящей или неактивной конформации.
В ооцитах, экспрессирующих EGFP-Kir 1.1a 331X, проводимость выше фона не обнаружена, что согласуется с предположением, что Kir 1.1a 331X находится в плазматической мембране, но находится в непроводящей или неактивной конформации.
Сравнение макроскопической проводимости с ограниченной интенсивностью флуоресценции плазматической мембраны в ооцитах, инъецированных любым слитым белком EGFP ( n = 5), еще больше усиливает этот вывод.Результаты этих исследований суммированы в C. Макроскопическая проводимость была прямо пропорциональна интенсивности флуоресценции в ооцитах, инъецированных EGFP-Kir 1.1a, как и предполагалось, если интенсивность периферической флуоресценции пропорциональна количеству каналов в плазмалемме. Следовательно, наблюдение, что периферическое распределение флуоресценции и интенсивность мутанта Kir 1.1a 331X неотличимы от канала дикого типа, обеспечивает доказательство того, что мутантный канал также преимущественно экспрессируется на плазматической мембране.
В совокупности эти результаты подтверждают, что весь крайний конец COOH Kir 1.1a (аминокислоты 332–391) не является необходимым для направления нацеливания на плазматическую мембрану Kir 1.1a и стабильности в системе экспрессии ооцитов Xenopus . Следовательно, потеря функции у мутанта Барттера, Kir 1.1a 331X, не связана с уменьшением количества каналов в плазмалемме. Вместо этого мутантные каналы существуют в непроводящей или неактивной конформации. Этот вывод был подтвержден исследованием серии усеченных мутантов по COOH-концу, как описано ниже.
Дефект гейтинга, обнаруженный в минимальном функциональном канале, Kir 1.1a 351X
Обнаружив, что крайний конец COOH участвует в поддержании активности канала, мы определили минимальный домен, необходимый для функциональной экспрессии, в надежде раскрыть механизм, лежащий в основе дефект Kir 1.1a 331X. В этих исследованиях канал постепенно реконструировали путем последовательного добавления частей крайнего конца COOH обратно к Kir 1. 1a 331X (A). Добавление аминокислот 332–351 было достаточным для восстановления минимальной функции канала, в то время как удаление этого домена изолированно (Kir 1.1а Δ332–351) приводит к потере канальной функции. Результаты этих исследований суммированы в B. Ооциты, инъецированные либо Kir 1.1a 341X, либо Kir 1.1a Δ332–351, как и Kir 1.1a 331X, не проявляют чувствительных к Ba 2+ токов выше фона ( n = 6 –11). Напротив, ооциты, инъецированные Kir 1.1a 351X, обнаруживают значительные, слабо выпрямляющие вовнутрь, макроскопические токи, чувствительные к Ba 2+ ( n = 10, P <0,001). Плотность тока еще больше увеличилась с добавлением еще 10 остатков (Kir 1.1a 361X, n = 11, P <0,0001). Добавление еще пяти остатков (Kir 1.1a 366X, n = 10) не привело к дальнейшему значительному увеличению активности канала. В совокупности эти исследования определяют аминокислоты 332–351 как критический COOH-концевой домен в пределах крайнего конца COOH, который абсолютно необходим для поддержания активности канала.
1a 331X (A). Добавление аминокислот 332–351 было достаточным для восстановления минимальной функции канала, в то время как удаление этого домена изолированно (Kir 1.1а Δ332–351) приводит к потере канальной функции. Результаты этих исследований суммированы в B. Ооциты, инъецированные либо Kir 1.1a 341X, либо Kir 1.1a Δ332–351, как и Kir 1.1a 331X, не проявляют чувствительных к Ba 2+ токов выше фона ( n = 6 –11). Напротив, ооциты, инъецированные Kir 1.1a 351X, обнаруживают значительные, слабо выпрямляющие вовнутрь, макроскопические токи, чувствительные к Ba 2+ ( n = 10, P <0,001). Плотность тока еще больше увеличилась с добавлением еще 10 остатков (Kir 1.1a 361X, n = 11, P <0,0001). Добавление еще пяти остатков (Kir 1.1a 366X, n = 10) не привело к дальнейшему значительному увеличению активности канала. В совокупности эти исследования определяют аминокислоты 332–351 как критический COOH-концевой домен в пределах крайнего конца COOH, который абсолютно необходим для поддержания активности канала.
Серия усеченных мутантов ограничивает аминокислоты 332–351 как COOH-концевой домен, необходимый для поддержания функции канала.(A) Каналы Kir 1.1a были реконструированы путем добавления остатков обратно к мутанту Барттера, Kir 1.1a 331X. Аминокислоты 332–361 представляют собой наиболее консервативный домен (30% идентичности) на крайнем конце COOH выпрямляющих внутрь каналов K + . (B) Показаны нормализованные Ba 2+ -чувствительные токи целых клеток (V m = -90 мВ), полученные из ооцитов, экспрессирующих каждый из усеченных мутантов, изображенных на A (* P <0,01). Замена аминокислот 332–351 (Kir 1.1a 351X) восстанавливает активность канала, а делеция этого домена (Kir 1.1a Δ332-351) устраняет макроскопические токи.
Путем идентификации активного канала, сохраняющего дефект, Kir 1.1a 351X, механизм, лежащий в основе роли COOH-терминального домена, может быть раскрыт. Природа дефекта была выяснена путем сравнения одноканальных свойств (присоединенная к клетке конфигурация) Kir 1. 1a 351X ( n = 5) с диким типом ( n = 4). Аберрантное стробирование было выявлено в записях большой продолжительности (∼20 мин), где P o контролировалось непрерывно с интервалом 15 с.Результаты двух репрезентативных записей показаны в A. В отличие от устойчивой кинетики с высокой вероятностью открытия канала дикого типа, каналы Kir 1.1a 351X демонстрировали всплески активности канала, «активное стробирование», прерываемое пребыванием в течение длительного времени. прожили в неактивном режиме ( т неактивен = 5,12 мин). Вследствие долгоживущего неактивного состояния вероятность открытия Kir 1.1a 351X была значительно снижена по сравнению с каналом дикого типа (0,36 ± 0.02 против 0,91 ± 0,01 соответственно; P <0,0001). В активном режиме стробирования каналы Kir 1.1a 351X показали одинаковую проводимость одного канала (γ = 40 ± 2 пСм), время открытия и закрытия (τ o = 20 ± 1,2 мс; τ c = 1,2 ± 0,1 мсек.
1a 351X ( n = 5) с диким типом ( n = 4). Аберрантное стробирование было выявлено в записях большой продолжительности (∼20 мин), где P o контролировалось непрерывно с интервалом 15 с.Результаты двух репрезентативных записей показаны в A. В отличие от устойчивой кинетики с высокой вероятностью открытия канала дикого типа, каналы Kir 1.1a 351X демонстрировали всплески активности канала, «активное стробирование», прерываемое пребыванием в течение длительного времени. прожили в неактивном режиме ( т неактивен = 5,12 мин). Вследствие долгоживущего неактивного состояния вероятность открытия Kir 1.1a 351X была значительно снижена по сравнению с каналом дикого типа (0,36 ± 0.02 против 0,91 ± 0,01 соответственно; P <0,0001). В активном режиме стробирования каналы Kir 1.1a 351X показали одинаковую проводимость одного канала (γ = 40 ± 2 пСм), время открытия и закрытия (τ o = 20 ± 1,2 мс; τ c = 1,2 ± 0,1 мсек.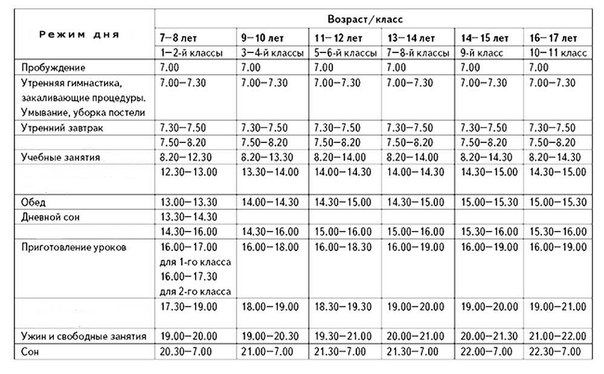 ) как каналы дикого типа (), что указывает на то, что делеция на COOH-конце не изменяет путь проводимости. Усечение крайнего конца COOH Kir 1.1a снижает активность канала, резко увеличивая вероятность проявления неактивного режима стробирования.Этот фенотип уникален для Kir 1.1a 351X; Открытая вероятность и проводимость одного канала Kir 1.1a 361X и Kir 1.1a 366X статистически не отличаются от канала дикого типа (B).
) как каналы дикого типа (), что указывает на то, что делеция на COOH-конце не изменяет путь проводимости. Усечение крайнего конца COOH Kir 1.1a снижает активность канала, резко увеличивая вероятность проявления неактивного режима стробирования.Этот фенотип уникален для Kir 1.1a 351X; Открытая вероятность и проводимость одного канала Kir 1.1a 361X и Kir 1.1a 366X статистически не отличаются от канала дикого типа (B).
Усечение COOH-терминала стабилизирует аберрантный неактивный режим стробирования. (A) Дневные графики активности одного канала в Kir 1.1a 351X по сравнению с диким типом. Показаны графики вероятности открытия, измеренные с 15-секундными интервалами в течение 20 мин. Одноканальные записи были получены в режиме прикрепления клеток (V m = -80 мВ) от ооцитов, инъецированных либо диким типом, либо Kir 1.1a 351X кРНК. Мутант демонстрирует неактивный режим со средней продолжительностью жизни 5,12 мин. (B) Средние вероятности открытия как для мутантов дикого типа, так и для усеченных ( n = 4–5), измеренные в течение 15–20-минутной записи (* P <0,0001). Редуктор П o Kir 1.1a 351X является результатом стабилизации долгоживущего неактивного состояния.
Редуктор П o Kir 1.1a 351X является результатом стабилизации долгоживущего неактивного состояния.
После спонтанного восстановления после инактивации каналы Kir 1.1a 351X проявляют биофизические свойства дикого типа.(A) Типичная одноканальная запись (режим присоединения ячейки, V m = -80 мВ), иллюстрирующая переход от активных к неактивным стробирующим конформациям. (B) Одноканальная проводимость (слева) и гистограммы среднего открытого (внизу справа) и закрытого (вверху справа) времени жизни Kir 1.1a 351X в активном режиме стробирования неотличимы от канала дикого типа (сравните с).
Хотя кинетика гейтирования Kir 1.1a 361X и Kir 1.1a 366X не изменилась по сравнению с диким типом, макроскопическая амплитуда тока канала дикого типа была значительно больше, чем у этих мутантов с COOH-концевой делецией.Это может отражать дефект в передаче каналов или стабильности плазматической мембраны, или значительную популяцию молчаливых каналов. Тем не менее, эти исследования определяют аминокислоты 332–351 как домен в крайнем конце COOH, который абсолютно необходим для поддержания каналов Kir 1. 1a в открытом состоянии.
1a в открытом состоянии.
ОБСУЖДЕНИЕ
Идентификация болезнетворных мутаций в канале Kir1.1a дает проницательные ключи к разгадке важных функциональных доменов, которые ранее ускользали от внимания.Например, определенная мутация, связанная с Барттером, сдвиг рамки считывания (T332 – K333), который заменяет последние 60 карбоксиконцевых аминокислот (332–391) на совершенно другой домен из 34 остатков (Simon et al. 1996b), крайний конец COOH как облигатный функциональный элемент. Как предсказано этой гипотезой, усечение COOH-терминального домена (Kir 1.1a 331X) дает полный фенотип потери функции. Выяснив механизм, лежащий в основе дефекта в Kir 1.1a 331X, мы обнаружили, что крайний конец COOH действует как обязательный детерминант стробирования канала, поддерживая канал в стабильном открытом состоянии.
Этот вывод подтверждается несколькими линиями доказательств. Поскольку Kir 1.1a 331X эффективно экспрессируется на плазматической мембране, потеря функции должна быть следствием неактивной конформации, а не дефектной поверхностной экспрессии. Характеризуя серию постепенно уменьшающихся усечений, был определен минимальный COOH-терминальный домен, который достаточен для восстановления функции (332–351), и был обнаружен дискретный дефект стробирования. Мутантные каналы, усеченные на крайней границе требуемого домена (351X), демонстрируют заметное поведение инактивации, характеризующееся частым заполнением в долгоживущем закрытом состоянии.После спонтанного восстановления после инактивации 351X приобрел режим активного стробирования, который проявляет точно такую же проводимость и кинетические свойства, что и канал дикого типа. Поскольку эти биофизические атрибуты отражают уникальную сигнатуру проникновения K + через поры Kir 1.1 (Лу и Маккиннон, 1994; Чоу и др., 1998), мутационный эффект 331X должен быть результатом аберрантного стробирования, а не постоянного или глубокого искажения проводящий путь. В совокупности эти данные демонстрируют, что крайний COOH-концевой домен необходим для поддержания каналов в открытом состоянии; каналы, лишенные этой модуляторной структуры, по-видимому, заблокированы в закрытой конформации.
Характеризуя серию постепенно уменьшающихся усечений, был определен минимальный COOH-терминальный домен, который достаточен для восстановления функции (332–351), и был обнаружен дискретный дефект стробирования. Мутантные каналы, усеченные на крайней границе требуемого домена (351X), демонстрируют заметное поведение инактивации, характеризующееся частым заполнением в долгоживущем закрытом состоянии.После спонтанного восстановления после инактивации 351X приобрел режим активного стробирования, который проявляет точно такую же проводимость и кинетические свойства, что и канал дикого типа. Поскольку эти биофизические атрибуты отражают уникальную сигнатуру проникновения K + через поры Kir 1.1 (Лу и Маккиннон, 1994; Чоу и др., 1998), мутационный эффект 331X должен быть результатом аберрантного стробирования, а не постоянного или глубокого искажения проводящий путь. В совокупности эти данные демонстрируют, что крайний COOH-концевой домен необходим для поддержания каналов в открытом состоянии; каналы, лишенные этой модуляторной структуры, по-видимому, заблокированы в закрытой конформации.
Следует отметить, что наш результат с мутантом 331X в ооцитах отличается от недавнего сообщения Schwalbe et al. 1998, который исследовал естественную мутацию сдвига рамки считывания T332-K333 в клетках насекомых Sf9. Эти исследователи сообщили, что каналы, несущие мутацию сдвига рамки считывания T332, преимущественно локализованы во внутриклеточном компартменте клеток Sf9, предположительно в Гольджи. Это может отражать, что экспрессия канала Kir 1.1 на плазматической мембране зависит от типа клетки-хозяина (Brejon et al.1999). Альтернативно, совершенно другой домен из 34 остатков, который вводится мутацией сдвига рамки считывания, может препятствовать правильному переносу на клеточную мембрану. Хотя мы не можем исключить роль этого домена в передаче каналов, мы обнаружили в ооцитах Xenopus , где канал эффективно экспрессируется, что COOH-концевой домен обычно действует как важный регулятор стробирования.
В настоящее время мы не можем утверждать с какой-либо уверенностью, как частичное усечение терминала COOH изменяет структуру канала и как это способствует переходу в состояние покоя; однако можно рассмотреть несколько механизмов. Например, механизм, с помощью которого внутриклеточный pH (Fakler et al. 1996; Choe et al. 1997; McNicholas et al. 1998) и PKA (McNicholas et al. 1994) регулируют активность Kir1.1a, дает некоторое представление о модулирующей роли карбоксильный концевой домен. Активность Kir1.1 зависит от PKA-опосредованного фосфорилирования трех остатков серина (S44, S219, S323), расположенных в NH 2 — и COOH-концевых доменах (Xu et al. 1996; MacGregor et al. 1998), тогда как падение цитоплазматического pH, обнаруживаемое при K80 (Fakler et al.1996; Choe et al. 1997), подавляет канал. Поскольку дефосфорилирование (MacGregor et al. 1998) и закисление цитоплазмы (Choe et al. 1997) вызывают состояние, напоминающее стробирующую конформацию, обеспечиваемую мутацией 351X, возникает соблазн предположить общий или связанный путь стробирования. С этой точки зрения крайний карбоксильный концевой домен может напрямую влиять на физиологическую регуляцию канала одним из двух различных способов. Этот домен может напрямую взаимодействовать с фосфоакцепторными и pH-сенсорными сайтами, подобно тому, как NH 2 -концевой домен в циклических нуклеотид-управляемых каналах взаимодействует с циклическим нуклеотид-связывающим доменом (Varnum and Zagotta 1997).
Например, механизм, с помощью которого внутриклеточный pH (Fakler et al. 1996; Choe et al. 1997; McNicholas et al. 1998) и PKA (McNicholas et al. 1994) регулируют активность Kir1.1a, дает некоторое представление о модулирующей роли карбоксильный концевой домен. Активность Kir1.1 зависит от PKA-опосредованного фосфорилирования трех остатков серина (S44, S219, S323), расположенных в NH 2 — и COOH-концевых доменах (Xu et al. 1996; MacGregor et al. 1998), тогда как падение цитоплазматического pH, обнаруживаемое при K80 (Fakler et al.1996; Choe et al. 1997), подавляет канал. Поскольку дефосфорилирование (MacGregor et al. 1998) и закисление цитоплазмы (Choe et al. 1997) вызывают состояние, напоминающее стробирующую конформацию, обеспечиваемую мутацией 351X, возникает соблазн предположить общий или связанный путь стробирования. С этой точки зрения крайний карбоксильный концевой домен может напрямую влиять на физиологическую регуляцию канала одним из двух различных способов. Этот домен может напрямую взаимодействовать с фосфоакцепторными и pH-сенсорными сайтами, подобно тому, как NH 2 -концевой домен в циклических нуклеотид-управляемых каналах взаимодействует с циклическим нуклеотид-связывающим доменом (Varnum and Zagotta 1997). Альтернативно и более вероятно (см. Ниже), домен может влиять на реальный механизм гейтирования, что было постулировано для объяснения функции «молекулярного тормоза» (Sansom 1999) цитоплазматического домена PAS в канале HERG (Morais Cabral et al. 1998). ). Недавнее наблюдение, что pH-зависимое закрытие канала совпадает со структурной перестройкой концов NH 2 и COOH (Schulte et al. 1998), подтверждает эту последнюю идею. В самом деле, COOH-терминальная структура (C308), которая претерпевает pH-зависимые аллостерические изменения, по-видимому, находится в непосредственной близости от модулирующего домена, который мы идентифицировали (332–351).
Альтернативно и более вероятно (см. Ниже), домен может влиять на реальный механизм гейтирования, что было постулировано для объяснения функции «молекулярного тормоза» (Sansom 1999) цитоплазматического домена PAS в канале HERG (Morais Cabral et al. 1998). ). Недавнее наблюдение, что pH-зависимое закрытие канала совпадает со структурной перестройкой концов NH 2 и COOH (Schulte et al. 1998), подтверждает эту последнюю идею. В самом деле, COOH-терминальная структура (C308), которая претерпевает pH-зависимые аллостерические изменения, по-видимому, находится в непосредственной близости от модулирующего домена, который мы идентифицировали (332–351).
В то время как фактический механизм, лежащий в основе регуляторной функции COOH-терминала, еще предстоит выяснить, наши данные в основном указывают на одну конкретную модель. Как подтверждают исследования прямого белок-белкового взаимодействия в Kir1.1 (Koster et al. 1998) и других внутренне выпрямляющих калиевых каналах (Tinker et al. 1996), доминирующее негативное поведение 331X выявило, что COOH-концевой домен (332– 391) не только контролирует занятость открытого состояния, но также является важным детерминантом олигомеризации субъединиц.Такие перекрывающиеся функции предполагают, что межсубъединичные взаимодействия в пределах конца COOH могут регулировать энергетику открытия канала. Соответственно, мы предполагаем, что нарушение межсубъединичных контактов внутри COOH-концевого домена изменяет четвертичную структуру тетрамера таким образом, что нарушает стабильность открытой поры, сравнимо с тем, как кислород вызывает аллостерические конформационные изменения в гемоглобине (Perutz и др. 1998).
1996), доминирующее негативное поведение 331X выявило, что COOH-концевой домен (332– 391) не только контролирует занятость открытого состояния, но также является важным детерминантом олигомеризации субъединиц.Такие перекрывающиеся функции предполагают, что межсубъединичные взаимодействия в пределах конца COOH могут регулировать энергетику открытия канала. Соответственно, мы предполагаем, что нарушение межсубъединичных контактов внутри COOH-концевого домена изменяет четвертичную структуру тетрамера таким образом, что нарушает стабильность открытой поры, сравнимо с тем, как кислород вызывает аллостерические конформационные изменения в гемоглобине (Perutz и др. 1998).
Принимая во внимание сходство в первичной структуре COOH-концевого домена в семействе внутренних выпрямляющих калиевых каналов, модулирующая функция этой структуры может иметь более широкое распространение.Внутри затронутого COOH-концевого домена Kir 1.1 (332–391) отдельная область, которая абсолютно необходима для функции канала (332–351), демонстрирует наивысшую степень консервативности аминокислот, разделяя примерно 30% идентичности с другими членами семейство вовнутрь-выпрямляющих каналов. Интересно, что Drain et al. 1998 недавно идентифицировал структурную детерминанту АТФ-зависимого гейтирования в отдаленно связанной субъединице K ATP , Kir 6.2, которая находится внутри этого умеренно консервативного домена. Принимая во внимание это наблюдение, крайний COOH-концевой домен может действовать на консервативную стробирующую структуру в семействе внутренних выпрямляющих калиевых каналов.
Интересно, что Drain et al. 1998 недавно идентифицировал структурную детерминанту АТФ-зависимого гейтирования в отдаленно связанной субъединице K ATP , Kir 6.2, которая находится внутри этого умеренно консервативного домена. Принимая во внимание это наблюдение, крайний COOH-концевой домен может действовать на консервативную стробирующую структуру в семействе внутренних выпрямляющих калиевых каналов.
Таким образом, мы выяснили механизм, лежащий в основе функционального дефекта конкретного мутанта Kir 1.1a, который был связан с семейной нефропатией с потерей соли, синдромом Барттера. Эти усилия показали, что ранее нераспознанный домен, крайний конец COOH, действует как важный модификатор стробирования канала.
Используйте групповую политику для развертывания отката по известной проблеме — клиент Windows
- Статья .
- 6 минут на чтение
Оцените свой опыт
да Нет
Любой дополнительный отзыв?
Отзыв будет отправлен в Microsoft: при нажатии кнопки «Отправить» ваш отзыв будет использован для улучшения продуктов и услуг Microsoft.Политика конфиденциальности.
Представлять на рассмотрение
Спасибо.
В этой статье
В этой статье описывается, как настроить групповую политику для использования определения политики отката известной проблемы (KIR), которое активирует KIR на управляемых устройствах.
Применимо к: Windows Server 2019 версии 1809 и более поздних версий; Windows 10 версии 1809 и более поздних версий
Сводка
Microsoft разработала новую технологию обслуживания Windows под названием KIR для Windows Server 2019 и Windows 10 версий 1809 и более поздних версий. Для поддерживаемых версий Windows KIR откатывает конкретное изменение, которое было применено как часть небезопасного выпуска Центра обновления Windows. Все остальные изменения, внесенные в этот выпуск, остаются без изменений. При использовании этой технологии, если обновление Windows вызывает регрессию или другую проблему, вам не нужно удалять все обновление и возвращать систему к последней удачной конфигурации. Вы откатываете только то изменение, которое вызвало проблему. Этот откат временный. После того, как Microsoft выпустит новое обновление, которое устраняет проблему, откат больше не нужен.
Для поддерживаемых версий Windows KIR откатывает конкретное изменение, которое было применено как часть небезопасного выпуска Центра обновления Windows. Все остальные изменения, внесенные в этот выпуск, остаются без изменений. При использовании этой технологии, если обновление Windows вызывает регрессию или другую проблему, вам не нужно удалять все обновление и возвращать систему к последней удачной конфигурации. Вы откатываете только то изменение, которое вызвало проблему. Этот откат временный. После того, как Microsoft выпустит новое обновление, которое устраняет проблему, откат больше не нужен.
Важно
KIR применяются только к обновлениям, не связанным с безопасностью. Это связано с тем, что откат исправления для обновления, не связанного с безопасностью, не создает потенциальной уязвимости в системе безопасности.
Корпорация Майкрософт управляет процессом развертывания KIR для некорпоративных устройств. Для корпоративных устройств Microsoft предоставляет файлы MSI с определениями политики KIR. Затем предприятия могут использовать групповую политику для развертывания KIR в гибридных доменах Azure Active Directory (Azure AD) или доменных служб Active Directory (AD DS).
Затем предприятия могут использовать групповую политику для развертывания KIR в гибридных доменах Azure Active Directory (Azure AD) или доменных служб Active Directory (AD DS).
Примечание
Необходимо перезагрузить затронутые компьютеры, чтобы применить это изменение групповой политики.
Процесс КИР
Если Microsoft определяет, что обновление, не связанное с безопасностью, имеет критическую регрессию или аналогичную проблему, Microsoft генерирует KIR. Microsoft объявляет KIR на панели мониторинга работоспособности Windows и добавляет информацию в следующие места:
Для клиентов, не являющихся корпоративными, процесс обновления Windows автоматически применяет KIR.От пользователя не потребуется никаких действий.
Корпоративным клиентам Microsoft предоставляет MSI-файл определения политики. Корпоративные клиенты могут распространить KIR на управляемые системы с помощью инфраструктуры корпоративной групповой политики.
Чтобы увидеть пример файла KIR MSI, загрузите Windows 10 (2004 и 20h3) Откат известной проблемы 031321 01. msi.
msi.
Определение политики KIR имеет ограниченный срок действия (максимум несколько месяцев). После того, как Microsoft опубликует исправленное обновление для решения исходной проблемы, в KIR больше нет необходимости.Затем определение политики можно удалить из инфраструктуры групповой политики.
Использование групповой политики для применения KIR к одному устройству
Чтобы использовать групповую политику для применения KIR к одному устройству, выполните следующие действия:
- Загрузите MSI-файл определения политики KIR на устройство.
Важно
Убедитесь, что операционная система, указанная в имени файла .msi, соответствует операционной системе устройства, которое вы хотите обновить.
- Запустите.msi на устройстве. Это действие устанавливает определение политики KIR в административном шаблоне.
- Откройте редактор локальной групповой политики. Для этого выберите Start , а затем введите gpedit.
 msc .
msc . - Выберите Политика локального компьютера > Конфигурация компьютера > Административные шаблоны > КБ ####### Проблема XXX Откат > Windows 10, версия YYMM .
Примечание
На этом этапе ####### — это номер статьи базы знаний обновления, вызвавшего проблему. XXX — это номер проблемы, а YYMM — это номер версии Windows 10.
- Щелкните политику правой кнопкой мыши и выберите Изменить > Отключено > OK .
- Перезагрузите устройство.
Дополнительные сведения об использовании редактора локальной групповой политики см. В разделе «Работа с параметрами политики административного шаблона с помощью редактора локальной групповой политики».
Использование групповой политики для применения KIR к устройствам в гибридном домене Azure AD или AD DS
Чтобы применить определение политики KIR к устройствам, которые принадлежат к гибридному домену Azure AD или AD DS, выполните следующие действия:
- Загрузите и установите файлы KIR MSI
- Создайте объект групповой политики (GPO).

- Создайте и настройте фильтр WMI, который применяет GPO.
- Свяжите объект групповой политики и фильтр WMI.
- Настройте GPO.
- Отслеживайте результаты GPO.
1. Загрузите и установите файлы KIR MSI
- Проверьте информацию о выпуске KIR или списки известных проблем, чтобы определить, какие версии операционной системы вам необходимо обновить.
- Загрузите MSI-файлы определения политики KIR, необходимые для обновления, на компьютер, который вы используете для управления групповой политикой в своем домене.
- Запустите файлы .msi. Это действие устанавливает определение политики KIR в административном шаблоне.
Примечание
Определения политикустанавливаются в папку C: \ Windows \ PolicyDefinitions .Если вы внедрили центральное хранилище групповой политики, необходимо скопировать файлы .admx и .adml в центральное хранилище.
2. Создайте объект групповой политики
- Откройте консоль управления групповой политикой и выберите Лес: Имя домена > Домены .

- Щелкните правой кнопкой мыши свое доменное имя, а затем выберите Создать объект групповой политики в этом домене и свяжите его здесь .
- Введите имя нового объекта групповой политики (например, KIR Issue XXX ), а затем выберите OK .
Дополнительные сведения о создании объектов групповой политики см. В разделе Создание объекта групповой политики.
3. Создайте и настройте фильтр WMI, который применяет GPO
Щелкните правой кнопкой мыши WMI Filters , а затем выберите New .
Введите имя для вашего нового фильтра WMI.
Введите описание вашего фильтра WMI, например Фильтр для всех устройств Windows 10 версии 2004 .
Выбрать Добавить .
В запросе введите следующую строку запроса:
ВЫБРАТЬ версию, тип продукта из Win32_OperatingSystem ГДЕ Версия =Важно
В этой строке
представляет версию Windows, к которой должен применяться объект групповой политики.  Номер версии должен иметь следующий формат (исключить скобки при использовании номера в строке):
Номер версии должен иметь следующий формат (исключить скобки при использовании номера в строке):10.0. ххххх
, где xxxxx — пятизначное число.В настоящее время KIR поддерживают следующие версии:
Версия Номер сборки Windows 10, версия 20h3 10.0.19042 Windows 10, версия 2004 10.0.19041 Windows 10, версия 1909 10.0.18363 Windows 10, версия 1903 10.0.18362 Windows 10, версия 1809 10.0,17763 Актуальный список выпусков Windows и номеров сборок см. В разделе Windows 10 — информация о выпусках.
Важно
Номера сборки, указанные на странице информации о выпуске Windows 10, не включают префикс 10.0 . Чтобы использовать в запросе номер сборки, необходимо добавить префикс 10.
 0 .
0 .
Дополнительные сведения о создании фильтров WMI см. В разделе Создание фильтров WMI для объекта групповой политики.
4. Свяжите объект групповой политики и фильтр WMI
- Выберите объект групповой политики, который вы создали ранее, откройте меню Фильтрация WMI , а затем выберите только что созданный фильтр WMI.
- Выберите Да , чтобы принять фильтр.
5. Настройте GPO
Измените свой GPO, чтобы использовать политику активации KIR
- Щелкните правой кнопкой мыши созданный ранее объект групповой политики и выберите Изменить .
- В редакторе групповой политики выберите GPOName > Конфигурация компьютера > Административные шаблоны > KB ####### Проблема XXX Откат > Windows 10, версия YYMM .
- Щелкните политику правой кнопкой мыши и выберите Изменить > Отключено > OK .

Дополнительные сведения о том, как редактировать объекты групповой политики, см. В разделе «Изменение объекта групповой политики из консоли управления групповыми политиками».
6. Отслеживайте результаты GPO
В конфигурации групповой политики по умолчанию управляемые устройства должны применить новую политику в течение 90–120 минут. Чтобы ускорить этот процесс, вы можете запустить gpupdate на затронутых устройствах, чтобы вручную проверить наличие обновленных политик.
Убедитесь, что каждое затронутое устройство перезагружается после применения политики.
Важно
Исправление, из-за которого возникла проблема, отключается после того, как устройство применит политику и перезапустится.
Дополнительная информация
Сводка по обменуKIR — Патология в UCLA, Лос-Анджелес, Калифорния (Калифорния)
Сводка по обмену KIR — Патология в UCLA, Лос-Анджелес, Калифорния (Калифорния)- Отчет 53-й Международной KIR-биржи UCLA (pdf)
- Отчет 52-й Международной KIR-биржи UCLA (pdf)
- Отчет 51-й Международной KIR-биржи UCLA (pdf)
- Отчет 50-й Международной KIR-биржи UCLA (pdf)
- Отчет 49-й Международной KIR-биржи UCLA (pdf)
- Отчет 48-й Международной KIR-биржи UCLA (pdf)
- Отчет 47-й Международной KIR-биржи UCLA (pdf)
- Отчет 46-й Международной KIR-биржи UCLA (pdf)
- Отчет 45-й Международной KIR-биржи UCLA (pdf)
- Отчет 44-й Международной KIR-биржи UCLA (pdf)
- Отчет 43-й Международной KIR-биржи UCLA (pdf)
- Отчет 42-й Международной KIR-биржи UCLA (pdf)
- Отчет 41-й Международной KIR-биржи UCLA (pdf)
- Отчет 40-й Международной KIR-биржи UCLA (pdf)
- Отчет 39-й Международной KIR-биржи UCLA (pdf)
- Отчет 38-й Международной KIR-биржи UCLA (pdf)
- Отчет 37-й Международной KIR-биржи UCLA (pdf)
- Отчет 36-й Международной KIR-биржи UCLA (pdf)
- Отчет 35-й Международной KIR-биржи UCLA (pdf)
- Отчет 34-й Международной KIR-биржи UCLA (pdf)
- Отчет 33-й Международной KIR-биржи UCLA (pdf)
- Отчет 32-й Международной KIR-биржи UCLA (pdf)
- Отчет 31-й Международной KIR-биржи UCLA (pdf)
- Отчет 30-й Международной KIR-биржи UCLA (pdf)
- Отчет 29-й Международной KIR-биржи UCLA (pdf)
- Отчет 28-й Международной KIR-биржи UCLA (pdf)
- Отчет 27-й Международной KIR-биржи UCLA (pdf)
- Отчет 26-й Международной KIR-биржи UCLA (pdf)
- Отчет 25-й Международной KIR-биржи UCLA (pdf)
- Отчет 24-й Международной KIR-биржи UCLA (pdf)
- Отчет 23-й Международной KIR-биржи UCLA (pdf)
- Отчет 22-й Международной KIR-биржи UCLA (pdf)
- Отчет 21-й Международной KIR-биржи UCLA (pdf)
- Отчет 20-й Международной KIR-биржи UCLA (pdf)
- Отчет 19-й Международной KIR-биржи UCLA (pdf)
- Отчет 18-й Международной KIR-биржи UCLA (pdf)
- Отчет 17-й Международной KIR-биржи UCLA (pdf)
- Отчет 16-й Международной KIR-биржи UCLA (pdf)
- Отчет 15-й Международной KIR-биржи UCLA (pdf)
- Отчет 14-й Международной KIR-биржи UCLA (pdf)
- Отчет 13-й Международной KIR-биржи UCLA (pdf)
- Отчет 12-й Международной KIR-биржи UCLA (pdf)
- Отчет 11-й Международной KIR-биржи UCLA (pdf)
Что такое известная проблема Откат Процесс KIR для устранения проблемы
Microsoft Откат известной проблемы a. k.a Функция KIR, разработанная как инструмент для быстрого реагирования на возникающие ошибки, которые вносятся обновлениями. Она имеет отличные возможности, которые могут позволить вам быстро восстанавливаться после регрессий без рисков, связанных с откатом критически важных средств защиты. Срок действия определения политики KIR ограничен (максимум несколько месяцев). После того, как Microsoft выпустит новое обновление, которое отключает новый код на уязвимых устройствах для решения проблемы, откат больше не нужен.
k.a Функция KIR, разработанная как инструмент для быстрого реагирования на возникающие ошибки, которые вносятся обновлениями. Она имеет отличные возможности, которые могут позволить вам быстро восстанавливаться после регрессий без рисков, связанных с откатом критически важных средств защиты. Срок действия определения политики KIR ограничен (максимум несколько месяцев). После того, как Microsoft выпустит новое обновление, которое отключает новый код на уязвимых устройствах для решения проблемы, откат больше не нужен.
При использовании этой технологии, если обновление Windows вызывает регрессию или другую проблему, вам не нужно удалять все обновление и возвращать систему к последней удачной конфигурации.Вы откатываете только то изменение, которое вызвало проблему. Этот откат временный.
Исправления в ежемесячных накопительных единицах включены по умолчанию. Если при исправлении обнаружена проблема, предприятия смогут управлять этой политикой. Службы, размещенные в Azure, и Windows работают вместе, чтобы обновить этот параметр политики на устройстве и отключить проблемное исправление.
KIR применяются только к обновлениям, не связанным с безопасностью. Это связано с тем, что откат исправления для обновления, не связанного с безопасностью, не создает потенциальной уязвимости в системе безопасности.
Что такое откат по известной проблеме?Откат известной проблемы (KIR) , новая возможность, которая может быстро вернуть поврежденное устройство обратно к продуктивному использованию, если проблема возникает во время обновления Windows. Первоначально он был разработан для процессов в пользовательском режиме с последними улучшениями, внесенными за последний год в ядро ОС и загрузчик для поддержки этой возможности в режиме ядра. T Возможность отката по известной проблеме будет работать только для обновлений Windows 10, не связанных с безопасностью.
Откат известной проблемы работает на уровне кода, который позволяет разработчикам Windows сохранить старый код и добавить необходимое исправление. Если исправление необходимо отменить, он оценивает политику, чтобы определить, следует ли Windows выполнять старый путь кода вместо обновленного кода, содержащего исправление. Если в политике указано, что исправление включено, запускается новый код, а если в политике указано, что исправление отключено, ОС возвращается к старому пути кода.
Если исправление необходимо отменить, он оценивает политику, чтобы определить, следует ли Windows выполнять старый путь кода вместо обновленного кода, содержащего исправление. Если в политике указано, что исправление включено, запускается новый код, а если в политике указано, что исправление отключено, ОС возвращается к старому пути кода.
Известная проблема Обратный откат объединился в функционально законченную систему, начиная с Windows 10 версии 2004.
Версия Windows —
- Windows 10, версия 20h3 или более поздняя
- Windows 10, версия 2004
- Windows 10 версий 1809 и 1909 частично поддерживает
Technology —
- Клиентские и серверные версии Windows
- Изменяется только двоичный код
- Поддержка режима пользователя и ядра
Скоро будет —
- MDM
- Поддержка гипервизора и Application Guard в Защитнике Windows (WDAG)
- Процессы System Guard
При наличии известной проблемы с исправлением ошибки в обновлении Microsoft может внести изменения в конфигурацию в облаке. Если ваше устройство подключено к Центру обновления Windows или Центру обновления Windows для бизнеса, вы получите уведомление об этом изменении, и оно вступит в силу при следующей перезагрузке.
Если ваше устройство подключено к Центру обновления Windows или Центру обновления Windows для бизнеса, вы получите уведомление об этом изменении, и оно вступит в силу при следующей перезагрузке.
Согласно Microsoft, хотя этим устройствам по-прежнему потребуется перезагрузка, в большинстве случаев мы определили и опубликовали откат до того, как у большинства устройств конечных пользователей была бы возможность даже установить обновление, содержащее проблему. Другими словами, большинство конечных пользователей никогда не увидят регресса!
Кредит — Microsoft | Конечный пользователь Сценарий, управляемый корпорацией Майкрософт Как работает откат известной проблемы на предприятии Для отката известной проблемы Microsoft публикует определенную групповую политику в Центре загрузки, которую можно использовать для настройки и применения политики отката (откат кода в последнем накопительном обновлении или LCU) внутри предприятия.Ссылка на групповую политику включена в статью базы знаний Центра обновления Windows и примечания к выпуску в качестве средства устранения «известной проблемы».


 msc .
msc .

 Номер версии должен иметь следующий формат (исключить скобки при использовании номера в строке):
Номер версии должен иметь следующий формат (исключить скобки при использовании номера в строке): 0 .
0 .