Что можно увидеть в электронный микроскоп: Какие органоиды обнаружены электронным микроскопом?
Увидеть незримое и почувствовать неосязаемое. На что еще способен электронный микроскоп? / Хабр
Ни для кого не секрет, что существуют вещи и организмы настолько маленькие, что увидеть их невооруженным глазом просто невозможно. Однако за последние сто лет наука шагнула далеко вперед. И теперь мы можем не только посмотреть на инфузорию, но и увидеть собственными глазами атомы, и даже, буквально, пощупать рельеф микроструктуры кристаллов. А все благодаря электронной микроскопии… Давайте разберемся, как такое возможно.
Перед вами небольшой обзор на электронные микроскопы и их возможности.
Изображение вируса Эбола, полученное при помощи просвечивающей электронной микроскопии
Несмотря на то, что «электронная микроскопия» звучит очень современно, запатентована она была еще в 1931 году германо-американским инженером и изобретателем Райнхольдом Руденбергом. Это был настоящий переворот в области изучения микроструктур.
В световом микроскопе, которым на тот момент пользовались исследователи, изображение давали световой луч и незамысловатая конструкция из оптических линз. В электронном микроскопе (ЭМ) роль луча выполнял поток электронов в вакууме, фокусируемый, словно линзами, электромагнитными катушками. В электронном микроскопе (ЭМ) роль луча выполнял поток электронов в вакууме, фокусируемый, словно линзами, электромагнитными катушками. Изображение передавалось на флюоресцирующий экран, где его можно было детально рассмотреть. Данная технология позволила исследовать микроструктуры твердых тел, их локальный состав, а также электромагнитные поля. |
▎В чем суть электронной микроскопии?
Как уже было сказано, на исследуемый объект подается пучок электронов, который фокусируется на образце при помощи электромагнитного поля. «Точка» фокусировки электронов имеет не более 5 нм в диаметре. Для сравнения, толщина волоса — 80 000 нм. При соприкосновении с объектом электроны частично проникают внутрь, вытесняя родные электроны и фотоны образца, которые, в свою очередь, попадают на лучевую трубку, где и формируется изображение.
▎Каковы преимущества электронной микроскопии?
- Первое и основное отличие от светового микроскопа — увеличение.
 Профессиональный современный световой микроскоп может увеличить изображение в 2 тысячи раз. Электронный микроскоп дает увеличение до 300 тысяч при разрешающей способности 0,5 нм. На таком увеличении уже можно рассмотреть атомы.
Профессиональный современный световой микроскоп может увеличить изображение в 2 тысячи раз. Электронный микроскоп дает увеличение до 300 тысяч при разрешающей способности 0,5 нм. На таком увеличении уже можно рассмотреть атомы. - Второе существенное преимущество — при помощи спектрального анализа рентгеновского излучения, возбуждаемого электромагнитным полем, можно изучить химический состав образца в конкретных точках.
- В процессе можно воздействовать на исследуемый объект: облучать, нагревать, намагничивать или деформировать. И полученная картинка будет динамически изменяться.
- Имеется возможность зафиксировать процессы на фото- или видеосъемку в высоком разрешении.
- Исследователь получает электронно-оптическую информацию, которую можно дополнить данными, основанными на дифракции электронов с материалом исследуемого объекта. К примеру, определение показателей кристаллографии при использовании дифракционного контраста.
- В растровой разновидности электронной микроскопии можно рассматривать рельеф поверхности объекта при помощи анализа катодолюминесценции.

▎А каковы недостатки?
А вот недостатков много:
- Во-первых, в отличие от светового микроскопа, в котором образец можно просто поместить под окуляр, в ЭМ для работы необходим вакуум. Поэтому исследуемые образцы должны быть хорошо обработаны и зафиксированы. А потому невозможно исследовать живые объекты.
- Во-вторых, необходимо сделать ультратонкий срез исследуемого образца: от 20 до 50 нм, который к тому же должен быть равномерным. Иначе электронный поток поглотится объектом и картинки не будет.
- В-третьих, требуется высокое напряжение — от 50 кВ. А вместе с ним и специальная система охлаждения.
- Из-за повышенной чувствительности и хрупкости ЭМ нужно размещать абсолютно неподвижно, на виброустойчивой колонне, в здании без внешних магнитных полей.
- ЭМ создает исключительно черно-белые изображения.
- И, конечно, стоимость.
 Далеко не каждый исследовательский центр может позволить себе ЭМ. Он дорог и при покупке, и в обслуживании.
Далеко не каждый исследовательский центр может позволить себе ЭМ. Он дорог и при покупке, и в обслуживании.
Теперь давайте рассмотрим основные виды электронной микроскопии.
А основных видов два:
- Трансмиссионная или просвечивающая электронная микроскопия (ПЭМ)
- Растровая или сканирующая электронная микроскопия (СЭМ)
Нитчатая водоросоль в световом микроскопе (а), СЭМ (б) и ПЭМ (в)
▎
Просвечивающий электронный микроскопПЭМ похож на обычный световой микроскоп, но вместо луча света используется поток электронов, а длина волны намного меньше, чем фотонная. Поэтому изображения получаются в более высоком разрешении.
Вирус свиного гриппа в просвечивающим электронном микроскопе
Фокусировка электронного потока осуществляется при помощи электромагнитных и электростатических линз. Возникают даже присущие фотонным микроскопам хроматические аберрации.
| У ПЭМ очень высокое разрешение, что позволяет разглядеть атомы вещества и детально рассмотреть, к примеру, возбудителя вирусного заболевания. Собственно, с появлением полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА), электронным микроскопом перестали активно пользоваться для определения вирусов. И дело опять в стоимости и трудоемкости.. |
Из недостатков: объект, помещаемый в ПЭМ, должен быть не толще 1 микрона, то есть как один слой волоса, разрезанного вдоль на 50 частей. А вторая проблема — размер. ПЭМ занимает целую комнату: высотой в человеческий рост и с блоком питания, размером со шкаф.
ㅤㅤㅤПросвечивающий электронный микроскоп
▎
Сканирующий электронный микроскопСЭМ позволяет получать изображение очень высокого разрешения.
 Узко сфокусированный луч электронов микрон за микроном сканирует поверхность изучаемого образца. СЭМ дает возможность, в том числе, получить трехмерное изображение. У данного типа микроскопов имеется большое количество датчиков, способных улавливать все вытесняемые электронами частицы: электроны, видимый инфракрасный и ультрафиолетовый спектры света, рентгеновское излучение.
Узко сфокусированный луч электронов микрон за микроном сканирует поверхность изучаемого образца. СЭМ дает возможность, в том числе, получить трехмерное изображение. У данного типа микроскопов имеется большое количество датчиков, способных улавливать все вытесняемые электронами частицы: электроны, видимый инфракрасный и ультрафиолетовый спектры света, рентгеновское излучение.| В отличие от ПЭМ, работа которого похожа на работу оптического микроскопа, работа СЭМ напоминает устройство старого телевизора. В таких телевизорах есть электронно-лучевая трубка. По ней в вакууме проходят электроны, испускаемые электронной пушкой, и есть система корректирующих движение линз, которые могут фокусировать или отклонять электроны. В СЭМ все то же самое, только электронами обстреливают исследуемый объект, а не люминофоры экрана, а вся поступающая информация фиксируется различными детекторами. |
ㅤㅤСканирующий электронный микроскоп
У СЭМ есть несколько принципиально разных режимов работы, которые зависят от детекторов.
Рассмотрим основные виды:
• Детектор вторичных электронов
Используется для определения морфологии поверхности образца, поскольку сигнал вторичных электронов высокочувствителен к рельефу, шероховатостям и неровностям. Чаще всего данный режим работы используется в биологии для определения пор, борозд и изломов, к примеру, при изучении бактериальной клетки.
Изображение пыльцы, полученное путем детектирования вторичных электронов
• Детектор обратно отраженных или обратно рассеянных электронов
Используется для определения состава разносоставного вещества со множеством включений, поскольку сигнал рассеянных электронов чувствителен к специальному композиционному контрасту. Таким образом, на получаемом изображении, вещества разного состава в одном объекте будут иметь разные оттенки серого. Данный режим применяется, в основном, в кристаллографии и биологии.
Данный режим применяется, в основном, в кристаллографии и биологии.
Морфология интерфейса между оксидной и металлической составляющими, сделанная в режиме детектирования отраженных электронов
• Энергодисперсионный спектрометр
Позволяет определить элементный состав веществ и включений исследуемого образца. Конечно, в большинстве случаев важнее определить химический, а не элементарный состав. Зато энергодисперсионный спектрометр позволяет точечно, для каждого микрокомпонента определить состав. Кроме того, для данного метода не требуется никаких реагентов. Используется в химии и кристаллографии.
Анализ элементного состава микрокомпонентов полированного образца анодного шлака с помощью энергодиспрсионного спектрометра
• Детектор прошедших электронов
Электроны, прошедшие тонкий срез образца насквозь, приходят к датчику под разным углом, что дает различную информацию об исследуемом объекте. Угол рассеивания зависит от толщины среза, материала образца и энергии первичного электронного пучка. Детектор передает псевдоцветное изображение, где каждый цвет соответствует своему сигналу.
Угол рассеивания зависит от толщины среза, материала образца и энергии первичного электронного пучка. Детектор передает псевдоцветное изображение, где каждый цвет соответствует своему сигналу.
Коррозия, распространяющаяся сквозь хромовое покрытие на стали. Изображение получено при помощи детектирования прошедших электронов.
• Детектор катодолюминесцентного излучения
Используется при изучении материалов, обладающих люминесценцией, то есть способные излучать видимый свет при попадании на них электронного потока.
| Катодолюминесценция — это, по сути, способность вещества замещать оставленные после облучения электронами дырки, захватывая свободные электроны и выделяя световую энергию. Это свойственно для металлов: чистых и с примесями. Свет, производимый металлом с примесью, будет другого оттенка, что и будет фиксироваться детектором.. |
Изображение циркона, полученное
СЭМ может работать исключительно с твердыми образцами в вакууме. Поэтому для работы с жидкостями, их необходимо подвергнуть глубокой заморозке. Зато форма и размер образца могут быть любыми в пределах объема рабочей камеры. Продуктивность работы повышается при нанесении на исследуемый образец тонкого слоя токопроводящего материала.
Поэтому для работы с жидкостями, их необходимо подвергнуть глубокой заморозке. Зато форма и размер образца могут быть любыми в пределах объема рабочей камеры. Продуктивность работы повышается при нанесении на исследуемый образец тонкого слоя токопроводящего материала.
Электронная микроскопия применяется во многих сферах науки и промышленности:
Биология и медицина
При помощи ЭМ можно осуществить томографию тканей, детально рассмотреть клетки, определить локализацию белков, увидеть вирус и даже выполнить фармацевтический контроль качества.
Физика, химия и кристаллография.
ЭМ позволяет изучить микроструктуры металлов и кристаллов вещества, классифицировать материалы, тестировать характеристики различных веществ, определять состав, поверхность и плотность объектов.
Полупроводники и хранение данных
С помощью ЭМ выявляются и редактируются неисправности систем, выполняется анализ дефектов.
Промышленность
ЭМ помогает определять параметры частиц и целых структур. Позволяет в динамике посмотреть на материалы в высоком разрешении. При необходимости дает возможность построения трехмерной модели микроструктуры.
| В некоторых сферах электронная микроскопия незаменима. Поэтому исследователи постоянно работают над усовершенствованием методов и возможностей в данной области. Рассмотрим некоторые из них. |
▎3D моделирование
В некоторых случаях, к примеру, в биологии и медицине, могут потребоваться не просто фотографии ультратонких срезов, а трехмерные изображения какой-либо ткани или организма.
Это возможно осуществить несколькими способами:
1. ПЭМ серийных срезов
Самый первый из подходов к трехмерному моделированию на электронном микроскопе. Способ заключается в создании ленты ультратонких срезов, которые собираются на специальной сетке, покрываемой углеродом и особым веществом — формваром.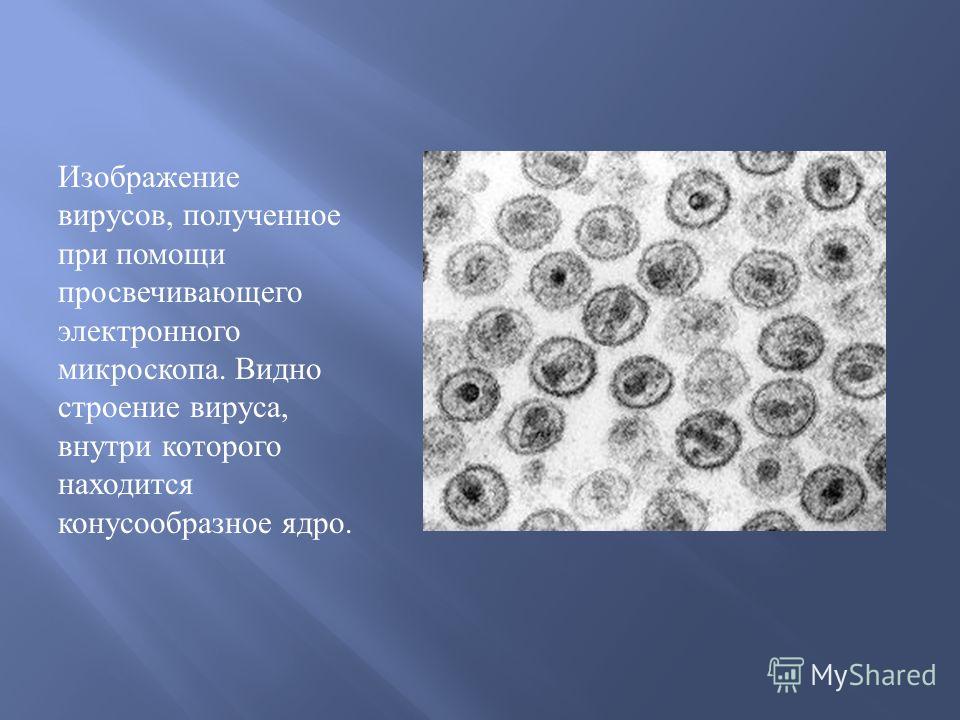 Полученные изображения обрабатываются в специальной программе: создается контур, фотографии выравниваются, обрезаются и сводятся в одно трехмерное изображение. Процесс сведения трудоемкий и занимает очень много времени, а размеры изображения ограничены. Еще одной проблемой являются существенные зазоры между слоями. Кроме того, ультратонкие срезы очень хрупкие и подвержены повреждениям. И чем их больше, тем выше шанс деформации образца.
Полученные изображения обрабатываются в специальной программе: создается контур, фотографии выравниваются, обрезаются и сводятся в одно трехмерное изображение. Процесс сведения трудоемкий и занимает очень много времени, а размеры изображения ограничены. Еще одной проблемой являются существенные зазоры между слоями. Кроме того, ультратонкие срезы очень хрупкие и подвержены повреждениям. И чем их больше, тем выше шанс деформации образца.
2. Криоэлектронная томография
По сравнению с ПЭМ серийных срезов, позволяет увидеть в более высоком разрешении более мелкие структуры, величиной от 3 нм, к примеру, элементы цитоскелета. Однако образцы должны быть довольно мелкими (100—500 нм) поэтому КЭТ не применима для крупных объектов и подходит только для молекулярных комплексов, вирусов и мелких бактерий.
Принцип метода криоэлектронной томографии
В процессе КЭТ объект исследования постепенно поворачивается и изображения получаются под разным углом наклона.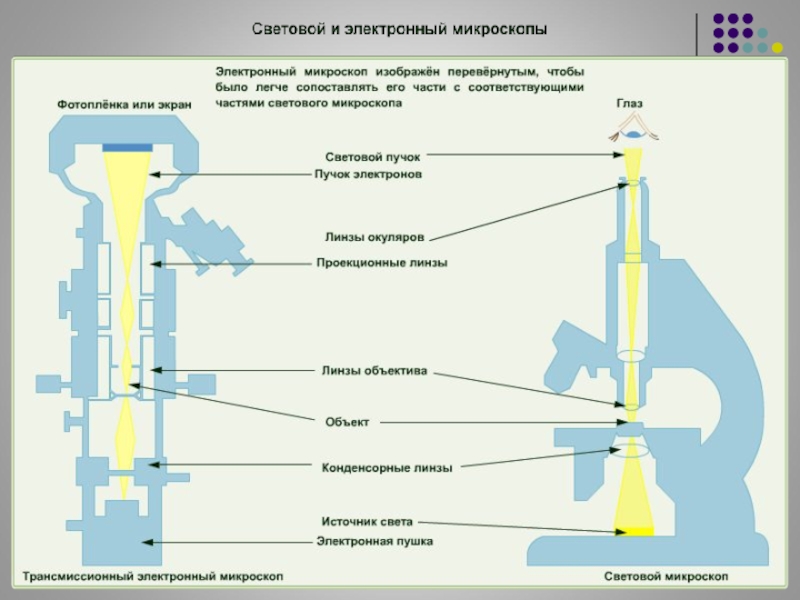 После этого все фотографии сводятся в одно 3D изображение. Минус метода в том, что образец получает высокую дозу излучения, за счет чего часть мелких деталей теряется в процессе исследования.
После этого все фотографии сводятся в одно 3D изображение. Минус метода в том, что образец получает высокую дозу излучения, за счет чего часть мелких деталей теряется в процессе исследования.
3. Многоэнергетическая деконволюция
При помощи этого метода можно получить несколько изображений образца на разной его глубине, не разрушая поверхности объекта. Такой эффект достигается за счет изменения ускоряющего напряжения электронов. И чем выше энергия, тем глубже в объект может проникнуть электрон. Каждое изображение будет давать характеристику определенного слоя. А специальный программный алгоритм соберет множество срезов в трехмерную модель с максимальным разрешением до 10 нм. Помимо прочего, данный метод можно использовать совместно с методом ультратонких срезов.
4. Фокусирующая ионно-лучевая сканирующая электронная микроскопия (ФИЛ-СЭМ)
Суть метода заключается в параллельном «разрезании» исследуемого образца на слои пучком ионов галлия и сканировании объекта электронным пучком. Слой получается толщиной 5—10 нм. Полученные изображения собираются в единую трехмерную модель.
Слой получается толщиной 5—10 нм. Полученные изображения собираются в единую трехмерную модель.
Раскрашенное изображение бактериофагов
(зеленые), поразивших кишечную палочку (голубые), сделанное в ФИЛ-СЭМ
Сложность метода в подготовке. Перед проведением операции необходимо защитить образец от части заряда. Для этого на сам объект, к примеру, кусок органа, напыляется металл, а блок, в который заключен образец, покрывается серебряной пастой. Максимальный размер моделируемого объекта — 100*100 мкм. Кроме того, метод очень долгий, а с увеличением глубины резки снижается качество.
Принцип метода ФИЛ-СЭМ
5. СЭМ с автоматизированной лентой для сбора срезов
По сути, это улучшенная версия метода серийных срезов. Специальная насадка на ультрамикротом, который делает срезы, работает автоматически и способна делать до 1000 срезов в день, помещая их на специальную ленту.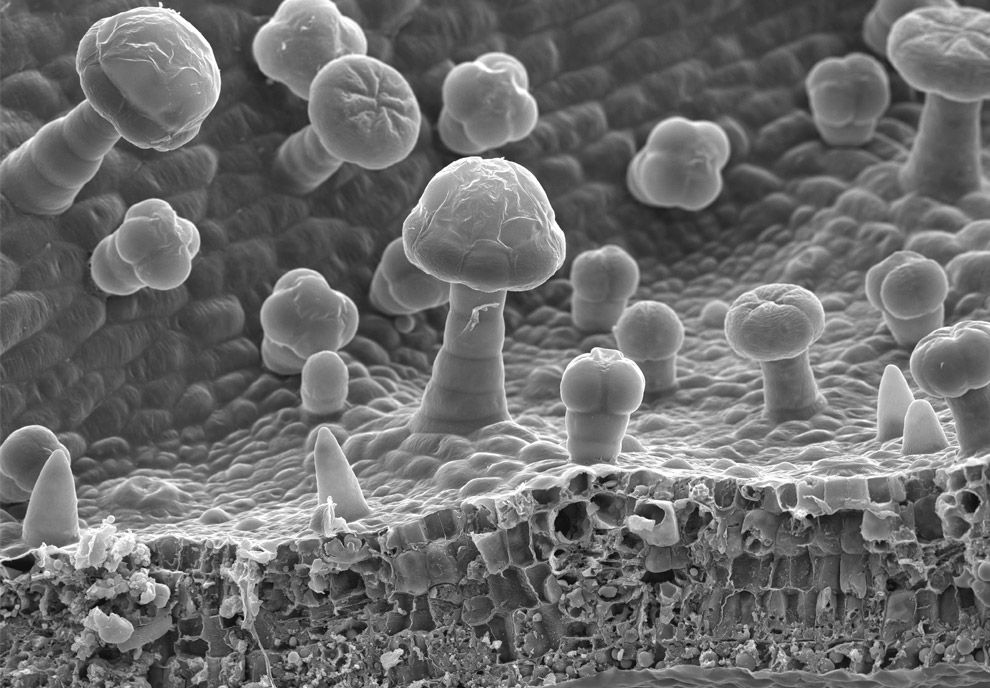 Далее лента разрезается на фрагменты, кладется на подложку, срезы обрабатываются контрастом и углеродом, после чего разрезанный образец помещается в СЭМ. Полученные изображения имеют разрешение 5 нм.
Далее лента разрезается на фрагменты, кладется на подложку, срезы обрабатываются контрастом и углеродом, после чего разрезанный образец помещается в СЭМ. Полученные изображения имеют разрешение 5 нм.
Ультрамикротом со специальной насадкой и вставленной лентой для срезов
6. Последовательная сканирующая электронная микроскопия поверхности блока
Используется для получения трехмерной модели большого объекта. Для этого ультрамикротом помещается внутрь СЭМ. В процессе происходит последовательное срезание ультратонких слоев образца с последующим сканированием. Для улучшения изображения может использоваться контраст. Преимущество данного метода заключается в величине объекта и скорости обработки информации. За получаемыми данными можно наблюдать в реальном времени.
▎Цветное изображение
Большим минусом ЭМ является черно-белое изображение. Однако и с этим ученые смогли справиться.

| Самый простой метод — коррелятивная свето-электронная микроскопия (КСЭМ). Для окрашивания изображения один и тот же объект фотографируется в световом и в электронном микроскопе, а затем программа соединяет два изображения. Однако из-за разницы в разрешении изображение лишь радужно подкрашивается согласно распределению флуоресцентного красителя. Выделить микроструктуры таким образом не удастся. |
Коррелятивная свето-электронная микроскопия элементов цитоскелета
Ученые объединили КСЭМ с трехмерной световой микроскопией, уже известной нам ФИЛ-СЭМ и с микроскопией сверхвысокого разрешения (СР-микроскопия), которая позволяет получить большее разрешение за счет объединения на экране множества снимков.
Срез ядер нейронов при микроскопии сверхвысокого разрешения
Составив изначально изображение высокого разрешения, ученые резали образец лучами ионов. Изображение получало цвет за счет световой микроскопии структурированного освещения, позволяющего увеличить разрешение снимка в два раза за счет поочередной подсветки отдельных точек при фоновом свечении остального образца, и одномолекулярной световой микроскопии, при которой флуоресценция красителя активируется слабым лазером. Одномолекулярная микроскопия позволяет получить изображение с разрешением 0,2 мкм. Все полученные изображения свели вместе и получили полноценные цветные снимки. С помощью данной методики удалось разглядеть, к примеру, ультраструктуру нейронов.
Одномолекулярная микроскопия позволяет получить изображение с разрешением 0,2 мкм. Все полученные изображения свели вместе и получили полноценные цветные снимки. С помощью данной методики удалось разглядеть, к примеру, ультраструктуру нейронов.
Трехмерные модели ядер нейронов, полученные при коррелятивной микроскопии
Итак, электронный микроскоп — вещь, во многих сферах незаменимая. Ученые потихоньку нивелируют его минусы и решают проблемы, связанные с его использованием. Возможно, в скором времени, из минусов останутся только размер и стоимость. Хотя… Может, и это исправимо?
| Автор: Соловьёва Софья, микробиолог. |
Использованная литература:
- Гоулдстейн Дж., Ньюбери Д., Эчлин П., Джой Д., Фиори Ч., Лифшин Ф. Растровая электронная микроскопия и рентгеновский микроанализ: в двух книгах. Пер. с англ. — М.: Мир, 1984. 303 с.
- Уманский Я.
 С., Скаков Ю. А., Иванов А. Н., Расторгуев Л. Н… Кристаллография, рентгенография и электронная микроскопия. — М.: Металлургия, 1982, 632 с.
С., Скаков Ю. А., Иванов А. Н., Расторгуев Л. Н… Кристаллография, рентгенография и электронная микроскопия. — М.: Металлургия, 1982, 632 с.
- СиндоД. Оикава. Т. Аналитическая просвечивающая электронная микроскопия. — М.: Техносфера, 2006, 256 с. ISBN 5-94836-064-4.
- Denk, W., & Horstmann, H. (2004). Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology, 2(11).
- Efimov, A. E., Tonevitsky, A. G., Dittrich, M., & Matsko, N. B. (2007). Atomic force microscope (AFM) combined with the ultramicrotome: A novel device for the serial section tomography and AFM/TEM complementary structural analysis of biological and polymer samples. Journal of Microscopy, 226(3), 207–217. doi.org/10.1111/j.1365-2818.2007.01773.x
- Peddie, C. J., & Collinson, L. M. (2014). Exploring the third dimension: Volume electron microscopy comes of age.
 Micron. Elsevier Ltd. doi.org/10.1016/j.micron.2014.01.009
Micron. Elsevier Ltd. doi.org/10.1016/j.micron.2014.01.009
- Schalek, R., Kasthuri, N., Hayworth, K., Berger, D., Tapia, J., Morgan, J., … Lichtman, J. (2011). Development of High-Throughput, High-Resolution 3D Reconstruction of Large-Volume Biological Tissue Using Automated Tape Collection Ultramicrotomy and Scanning Electron Microscopy. Microscopy and Microanalysis, 17(S2), 966–967. doi.org/10.1017/S1431927611005708
- Wagner, J., Schaffer, M., & Fernández-Busnadiego, R. (2017, September 1). Cryo-electron tomography—the cell biology that came in from the cold. FEBS Letters. Wiley Blackwell. doi.org/10.1002/1873-3468.12757
- https://biomolecula.ru/articles/po-tu-storonu-difraktsionnogo-barera-nobelevskaia-premiia-po-khimii-2014
- https://biomolecula.ru/articles/fluorestsiruiushchaia-nobelevskaia-premiia-po-khimii
- https://biomolecula.ru/articles/tsvet-3d-i-sverkhvysokoe-razreshenie-novaia-razrabotka-v-mikroskopii
Как работает электронный микроскоп? Разбор
Давайте начнем с маленькой загадки — как вы думаете, что это такое?
Ну а пока представьте, что вы хотите рассмотреть что-то очень маленькое, то что невозможно увидеть просто “присмотревшись повнимательнее”? Или вы хотите увидеть самые мелкие детали чего-то? Что вы используете?
Первое, что приходит в голову — использовать лупу или сразу взяться за микроскоп!
Но что делать, если вы хотите рассмотреть саму структуру чего-то, например, увидеть транзистор в процессоре?
Что вы сделаете? Просто переключитесь в микроскопе на линзу с большим увеличением? Сработает ли это?
Сегодня мы с вами покроем множество очень интересных тем:
- посмотрим на настоящий электронный микроскоп,
- поймем — зачем он вообще нужен,
- разберемся как увеличить что-то в сотни тысяч раз с помощью электронов и расскажем как человек научился видеть отдельные атомы!
Все как вы любите! Подробно и понятно…
Ну и еще сразу вам тут затравочку — сегодня мы посмотрим на Droider в настоящий электронный микроскоп! И нет — это не кликбейт!
youtube.com/embed/qSHK7NIk8h5?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Наверняка кто-то из вас в детстве по примеру Шерлока Холмса с помощью обычной линзы разглядывал все вокруг! Ведь это так круто видеть что-то в увеличении — создается ощущение, что открывается абсолютно новый, неизведанный маленький мир.
Так вот, если говорить простыми словами, то по принципу обычной увеличительной линзы и работает обычный оптический микроскоп!
Конечно, его устройство сильно сложнее — микроскоп это комбинация линз с заранее подобранными оптическими параметрами, которые собраны в правильной комбинации. Однако, сам принцип работы остается тем же.
Свет в видимом диапазоне длин волн либо проходит сквозь объект, либо отражается от поверхности, и, проходя, через систему увеличивающих и фокусирующих линз попадает сначала в окуляр и потом к нам в глаз.
Современные оптические микроскопы — это действительно массивные и сложные устройства, состоящие из десятков различных линз и зеркал, которые собраны в особом порядке, чтобы дать человеку возможность смотреть на объекты разного типа и с разным увеличением!
И линзы бывают разные. От линз с 2-3 кратным увеличением до довольно массивных линз со способностью увеличивать объекты в 100 раз. Только посмотрите на разрез линзы от компании Цайз с 50кратным увеличением! А комбинацией с правильным окуляром можно добиться увеличения даже в две тысячи раз.
От линз с 2-3 кратным увеличением до довольно массивных линз со способностью увеличивать объекты в 100 раз. Только посмотрите на разрез линзы от компании Цайз с 50кратным увеличением! А комбинацией с правильным окуляром можно добиться увеличения даже в две тысячи раз.
Проблема
И тут мы можем задать вопрос — в чем же тогда проблема вообще? Ведь можно просто до безумия искривлять линзы и создавать сложные системы, которые будут увеличивать даже в десятки тысяч раз. Таким образом мы и сможем посмотреть на самые крошечные детали чего угодно! Но все как обычно очень непросто и связано это с физическими ограничениями видимого света!
Ведь видимый свет это волна с определенной длинной. Оптический микроскоп использует его оптический спектр, то есть примерно от 800 до 400 нанометров.
А физика, бессердечная такая сволочь, к сожалению не позволяет нам, различать объекты, которые меньше примерно половины длины волны. То есть с помощью обычного оптического микроскопа, мы не сможем различить ничего что мельче примерно 200 нанометров.
Это ограничение получило название в честь Немецкого ученого Эрнста Аббе, которое так и называется — Дифракционный предел Аббе. И он позволяет получить значение минимального разрешения не только для видимого света, но и для любой другой электромагнитной волны. Вы ведь помните что свет — это тоже электромагнитная волна?
Внимательный наш читатель вспомнит, что эту же формулу мы показывали вам в ролике про экстремальную ультрафиолетовую литографию, когда говорили об ограничении разрешения для глубокого ультрафиолета. Так вот тут тоже самое.
Современные микроскопы со специальными линзами, конечно, умеют смотреть на маленькие объекты и позволяет, например, увидеть живые клетки или даже бактерии, но этого все равно не хватает, например, чтобы увидеть вирусы — тот же самый SARS-COV-2.
Решение проблемы
И как же обойти эту проблему? Да и вообще возможно ли ее обойти? Оказалось? что да. В целом есть два пути.
STED микроскопия
Первый путь, о котором мы вам тут расскажем — это изобретение за которое совсем недавно, в 2014 году, была вручена Нобелевская премия по химии.
Это так называемая STED или микроскопия на основе подавления спонтанного испускания. Именно она позволяет преодолеть дифракционный предел оптического микроскопа.
Правда у технологии есть ограничение — совсем не все материалы можно рассмотреть в такой микроскоп. Но она позволила видеть различные сложные белковые, да и другие органические соединения!
Это связано с тем, что необходимо смотреть на материалы, которые могут переходить в особое состояние под воздействием лазерного излучения. То есть в состояние, когда они сами начинают испускать свет!
Как же это работает?
Тут используется два лазера, один из которых называется возбуждающий лазер, и второй, специально подобранный по параметрам длины волны. Он называется охлаждающим лазером.
Этот охлаждающий лазер компенсирует по периметру возбуждение от первого лазера и в результате сочетания этих волн создается очень маленькая область, которая начинает светиться. Появилась возможность различать объекты величиной уже около 30 нм, что уже позволяет видеть вирусы, например! А это почти в 7 раз меньше, чем у обычного микроскопа! Все равно, что с Земли рассмотреть футбольный мяч на Луне! Вот такой вот элегантный метод обмануть физику!
Электронный микроскоп
Ну хорошо. Теперь мы разобрались с тем, как можно преодолеть физический барьер в оптической микроскопии. Какой же второй путь обхода барьера? Да и что делать, если мы хотим увидеть неорганические вещества или вообще что-то меньше 30 нанометров?
Теперь мы разобрались с тем, как можно преодолеть физический барьер в оптической микроскопии. Какой же второй путь обхода барьера? Да и что делать, если мы хотим увидеть неорганические вещества или вообще что-то меньше 30 нанометров?
И тут мы опять возвращаемся к нашей формуле, которая говорит нам о том, что максимальное разрешение — это половина длины электромагнитной волны. И ученые подумали — а зачем использовать видимый спектр, когда можно взять что-то с очень короткой длиной волны и пошли смотреть, что же там есть в коротковолновом спектре!
В общем, они решили не мелочиться и использовать сразу пучок электронов. Ведь длина волны электронов, ускоренных в электрическом поле равна примерно 0,4 Ангстрем. Или 0.04 нанометра! Это в 10 тысяч раз меньше, чем у видимого света! Кстати, если вы не знали, то размер атома водорода как раз около 1 Ангстрема. Итак, давайте разберемся что же такого крутого в электронных микроскопах!
Источник электронов и линзы
Сам концепт и первый прототип такого микроскопа был представлен, вы не поверите, еще в 1932 году, в Германии, и выглядел он вот так!
В целом, принцип работы с тех пор остался почти неизменный, хотя конечно его использование стало намного более User Friendly.
Но как же он работает?
Если вы смотрели наше крутое видео о магии создания процессора или читали материал, то там мы рассказывали, что для испарения некоторых материалов используется сфокусированный луч электронов и источником этих электронов служит вольфрамовая нить. В электронном микроскопе все примерно также. Зачастую вольфрам служит источником электронов. Тонкая нить нагревается до высоких температур и начинает испускать электроны в большом количестве.
А дальше начинается самое интересное. Эти электроны надо ускорить и сфокусировать. Да — сфокусировать именно так, как вы фиксируете свет в вашем объективе или обычном оптическом микроскопе. Только в этом случае воспользоваться стеклянными линзами просто не получится — весь электронный пучок полностью поглотится на самой первой линзе. В итоге для этого надо использовать электростатические линзы. Фактически, это такие электроды специальной формы, которые создает определенное электромагнитное поле. Это и позволяет фокусировать луч электронов, а также ускорять их до больших энергий!
Так же как и свет, падающий на поверхность материала в оптическом микрокопе, электронный луч дает нам информацию и позволяет фактически увидеть образец.
СЭМ
Тут стоит сказать, что в целом существует два основных типа электронных микроскопов, которые очень сильно отличаются.
Первый — это так называемый сканирующий электронный микроскоп, или просто СЭМ.
В нем сфокусированный пучок электронов попадает на поверхность образца практически любого размера, и происходит магия физики, из-за которой одни электроны выбивают другие электроны из атомов материала, на который мы смотрим.
Эти новые электроны называются вторичными и обладают относительно маленькими энергиями, что и позволяет специальному детектору их легко улавливать. Появление этих вторичных электронов происходит очень локально и это позволяет повысить точность получение изображения.
Дальше сфокусированный пучок начинает сканировать поверхность материала и в зависимости от рельефа поверхности на детектор попадает разное количество вторичных электронов. Вот так и получается картинка.
Именно поэтому все изображения с электронного микроскопа черно-белые. То есть фактически — это просто разная интенсивность в разных участках снимка. А любые цветные изображения с электронного микроскопа — это просто раскрашенные картинки.
То есть фактически — это просто разная интенсивность в разных участках снимка. А любые цветные изображения с электронного микроскопа — это просто раскрашенные картинки.
СЭМы — самые часто используемые микроскопы на производствах процессоров, так как они позволяют быстро посмотреть на качество поверхности, да и вообще их используют для контроля на каждом этапе изготовления.
ПЭМ
И перед тем, как мы посмотрим на Droider в микроскоп, надо рассказать про еще один незаменимый инструмент в руках ученых и инженеров!
Это просвечивающий электронный микроскоп или ПЭМ! Это огромная труба, занимающая одну, а то и две комнаты. А стоит он около миллиона долларов. Но на самом деле интересно не то сколько он стоит, тут понятно что такая техника очень дорогая.
Интересно то, что для его работы строят специальные комнаты, с огромными бетонными подушками, уходящими на много метров под землю. Они нужны чтобы гасить любые вибрации и возмущения — вот настолько чувствительно это оборудование.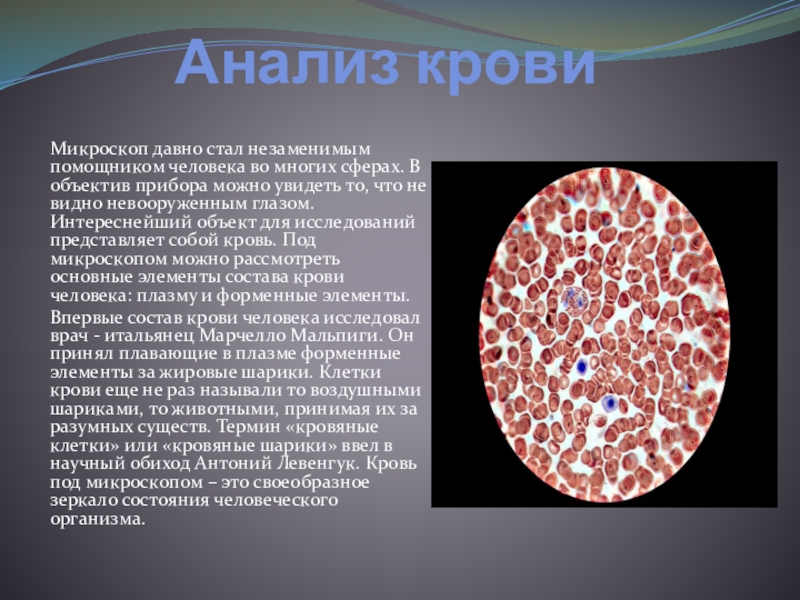 Если бы не такие подушки, то любое изображение было бы смазанным из-за того, что кто-то хлопнул дверью в другом конце здания.
Если бы не такие подушки, то любое изображение было бы смазанным из-за того, что кто-то хлопнул дверью в другом конце здания.
Его отличие от СЭМа в том, что он имеет гораздо большее разрешение! И связано это с особенностями самого образца и пучка электронов.
Если в СЭМе мы регистрировали новые электроны, которые вылетели из нашего образца под воздействием электронного пучка, то в ПЭМе мы смотрим на то как меняется наш исходный пучок электронов, который пролетел сквозь образец.
Суть в том, что пролетая через образец и взаимодействуя с атомами материала электроны меняются, а дальше попадают в детектор, который уже и говорит нам о том, как именно поменялся сам исходный пучок электронов.
Если вы внимательно слушали наше объяснение, то вы можете спросить, как же так — ведь электроны просто рассеются в образце и мы ничего не увидим.
И вы будете абсолютно правы! Ведь для ПЭМа нужно специально подготавливать образцы — они должны быть очень тонкими. До 100 нанометров, а вообще чем тоньше, тем лучше. В идеале всего десять-двадцать нанометров.
В идеале всего десять-двадцать нанометров.
Для этого используются сложные методы подготовки образцов, например специальный луч ионов, который как тонкий лазер вырезает маленький кусок образца, который потом исследуют уже в микроскопе. Это и позволяет с помощью ПЭМа ученым видеть даже отдельные атомы!
Вот посмотрите: каждая точка это атом Палладия, видно даже то насколько ровная кристаллическая решетка у материала! Обратите внимание на шкалу в левом нижнем углу, всего один нанометр. И мы уже сейчас можем такое видеть, потрясающе!
Droider в электронном микроскопе
Теперь когда мы с вами разобрались с тем, как работает электронный микроскоп — настало время посмотреть на надпись Droider в настоящий электронный микроскоп, а точнее в СЭМ. Она была вырезана лазером на тонком листе нержавеющей стали. Более того были сделаны много надписей от большой, до надписи размером несколько микрометров.
Тут вы видите загрузку этой пластины в микроскоп!
А вот сама пластина в микроскопе уже. Кстати на всех этих картинках обращайте внимание на шкалу масштаба и на цифры в у параметра Mag, то есть увеличение! Вот уже можно рассмотреть надпись Droider с увеличением в 55 раз.
Кстати на всех этих картинках обращайте внимание на шкалу масштаба и на цифры в у параметра Mag, то есть увеличение! Вот уже можно рассмотреть надпись Droider с увеличением в 55 раз.
Так едем вниз к надписи поменьше.
Интересно, а какой толщины буква i в этой надписи — давайте глянем. Всего 100 микрометров, чуть толще человеческого волоса.
Так? но есть надпись и еще меньше — едем еще ниже и смотрим внимательнее.
Тут уже видно что увеличение 200 раз, но сама надпись уже плохо различима. Но это проблема не микроскопа, а лазера которым вырезалась надпись. Он просто не может такую мелкую надпись сделать! Ведь тут буква i уже 40 микрометров.
Но раз мы уткнулись в ограничения лазера, то давайте вернемся обратно, к самой большой надписи и посмотрим на структуру самой стали. Итак вот самая большая i. Пол миллиметра в толщине. Приближаем к нижнему краю.
Так увеличение уже почти полторы тысячи раз. Самое время посмотреть на то какой толщины след от лазера. Всего 40 микрометров.
Всего 40 микрометров.
Едем еще ближе и вот увеличение уже 6300 раз. Вот и ответ на наш вопрос из начала видео — это структура обработанной и необработанной стали!
Давайте посмотрим еще ближе теперь увеличение уже 40 тысяч раз. Мы уже в наномире! Смотрите какая красота — это сталь, по которой прошелся лазерный луч, когда вырезал букву i в слове Droider!
Но еще интересно глянуть, как выглядела сталь до обработки — что ж давайте глянем с таким же увеличением. Разница огромная!
Ну и наконец, давайте глянем на обработанную сталь с огромным увеличением в 300 тысяч раз. Ширина этого канала от лазера всего 300 нанометров!
Выводы
Электронный микроскоп — незаменимый инструмент в руках ученых и инженеров. Он не просто позволяет посмотреть на что-то маленькое — он позволяет увидеть саму структуру материалов, вплоть до атомов! Кроме того эти микроскопы позволяют смотреть не только на структуру, но и определять химический состав материала!
Это все очень полезно, когда например инженеры на производстве микропроцессоров или экранов пытаются понять, где и какой материал они осадили, как выглядят их транзисторы, много ли дефектов, да и вообще выявить брак.
Конечно, мы тут почти не сказали о том, как подготавливаются образцы для изучения, и например о том, что все такие микроскопы работают в глубоком вакууме, для получения которого используют специальные насосы, которые вращаются со скоростью в 50 тысяч оборотов в минуту. В общем, нам есть, что обсудить и рассказать…
Post Views: 6 308
Современное использование электронной микроскопии для обнаружения вирусов
1. Адриан, М., Дж. Дюбоше, Дж. Лепо и А. В. МакДауэлл. 1984. Криоэлектронная микроскопия вирусов. Природа 308 : 32-36. [PubMed] [Google Scholar]
2. Almeida, JD 1963. Классификация вирусов на основе морфологии. Может. Мед. доц. J. 89 : 787-798. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Almeida, JD, and AP Goffe. 1965. Антитела к вирусу бородавок в сыворотке крови человека продемонстрированы с помощью электронной микроскопии и тестов на преципитацию. Ланцет II : 1205-1207. [PubMed] [Google Scholar]
Ланцет II : 1205-1207. [PubMed] [Google Scholar]
4. Алмейда, Дж. Д., и А. Д. Уотерсон. 1970. Некоторые последствия морфологически ориентированной классификации вирусов. Арка Gesamte Virusforsch. 32 : 66-72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Anderson, TF, and WM Stanley. 1941 г. Изучение с помощью электронного микроскопа реакции между вирусом табачной мозаики и его антисывороткой. Дж. Биол. хим. 139 : 339-344. [Google Scholar]
6. Bayer-Garner, IB 2005. Вирус оспы обезьян: гистологические, иммуногистохимические и электронно-микроскопические данные. Дж. Кутан. Патол. 32 : 28-34. [PubMed] [Google Scholar]
7. Biel, S.S., A. Nitsche, A. Kurth, W. Siegert, M. Ozel и HR Gelderblom. 2004. Обнаружение полиомавирусов человека в моче пациентов с трансплантацией костного мозга: сравнение электронной микроскопии с ПЦР.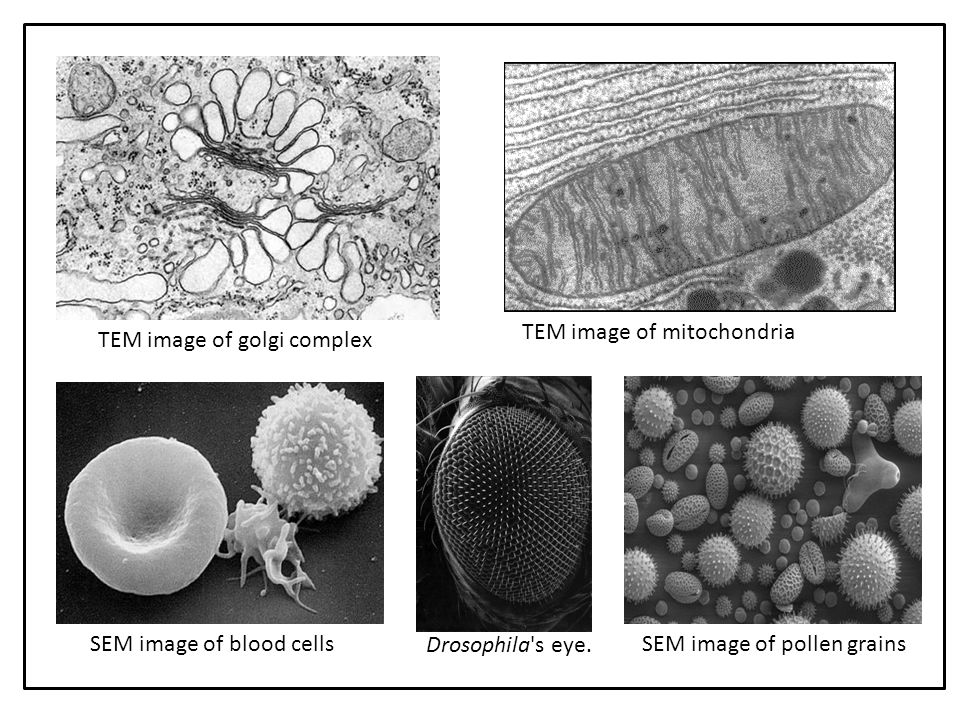 клин. хим. 50 : 306-312. [PubMed] [Google Scholar]
клин. хим. 50 : 306-312. [PubMed] [Google Scholar]
8. Боуэн, Э. Т., Г. Ллойд, У. Дж. Харрис, Г. С. Платт, А. Баскервиль и Э. Э. Велла. 1977. Вирусная геморрагическая лихорадка в южном Судане и северном Заире. Предварительные исследования этиологического агента. Ланцет i : 571-573. [PubMed] [Google Scholar]
9. Брике С. и К. Вакеро. 2002. Иммунолокальные исследования антисмыслового белка в ВИЧ-1-инфицированных клетках и вирусных частицах. Вирусология 292 : 177-184. [PubMed] [Google Scholar]
10. Бузинаро, М. Г., П. П. Фрейтас, Дж. Дж. Киселлиус, М. Уеда и Дж. А. Херес. 2003. Идентификация бисегментированного двухцепочечного РНК-вируса (пикобирнавируса) в фекалиях телят. Вет. J. 166 : 185-187. [PubMed] [Google Scholar]
11. Carter, KC 2003. Возникновение причинно-следственных концепций болезней: истории болезни. Ашгейт, Олдершот, Хэмпшир, Великобритания.
Ашгейт, Олдершот, Хэмпшир, Великобритания.
12. ЦКЗ. 2006. Протокол электронной микроскопии с отрицательным окрашиванием при сыпи. http://www.bt.cdc.gov/agent/smallpox/lab-testing/pdf/em-rash-protocol.pdf.
13. ЦКЗ. 1988. Перспективы профилактики заболеваний и обновления здоровья: универсальные меры предосторожности для предотвращения передачи вируса иммунодефицита человека, вируса гепатита В и возбудителей, передающихся через кровь, в медицинских учреждениях. MMWR Морб. Смертный. еженедельно. Респ. 37 : 377-388. [PubMed] [Google Scholar]
14. Чен Д., Р. Нимс, С. Дусинг, П. Миллер, В. Луо, М. Квертинмонт, Б. Парех, Дж. Пурбо, Дж. А. Буз и Э. М. Аткинсон. 2008 г. Расследование первопричины инцидента с вирусным загрязнением, произошедшего во время тестирования и характеристики главного банка клеток (MCB) — тематическое исследование. Биопрепараты 36 : 393-402. [PubMed] [Google Scholar]
15. Chua, K.B., E.M. Wong, B.C. Cropp, and AD Hyatt. 2007. Роль электронной микроскопии в расследовании и борьбе со вспышками вируса Нипах. Мед. J. Малайзия 62 : 139-142. [PubMed] [Google Scholar]
Chua, K.B., E.M. Wong, B.C. Cropp, and AD Hyatt. 2007. Роль электронной микроскопии в расследовании и борьбе со вспышками вируса Нипах. Мед. J. Малайзия 62 : 139-142. [PubMed] [Google Scholar]
16. Cossart, YE., AM Field, B. Cant, and D. Widdows. 1975. Парвовирусоподобные частицы в сыворотке крови человека. Ланцет i : 72-73. [PubMed] [Google Scholar]
17. Dalton, A.J., and F. Haguenau. 1973. Ультраструктура вирусов животных и бактериофагов: атлас. Academic Press, Нью-Йорк, штат Нью-Йорк.
18. Доан, Ф. В. и Н. Андерсон. 1987. Электронная микроскопия в диагностической вирусологии: практическое руководство и атлас. Издательство Кембриджского университета, Нью-Йорк, штат Нью-Йорк.
19. Доан, Ф. В., Н. Андерсон, Дж. Чао и А. Нунан. 1974. Двухчасовая процедура встраивания для внутриклеточного обнаружения вирусов с помощью электронной микроскопии.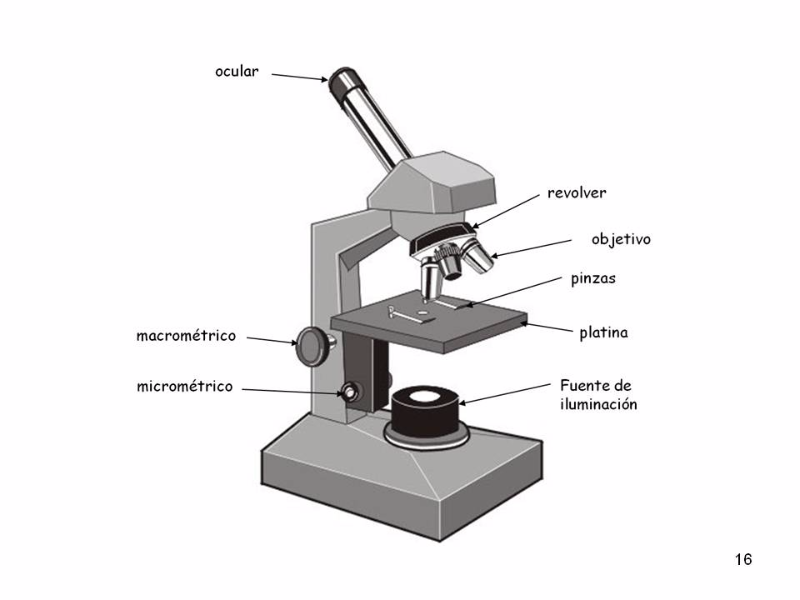 заявл. микробиол. 27 : 407-410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
заявл. микробиол. 27 : 407-410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Дростен К., С. Гюнтер, В. Прейзер, С. ван дер Верф, Х. Р. Бродт, С. Беккер, Х. Рабенау, М. Паннинг, Л. Колесникова, Р. А. Фушье, А. Бергер, А. М. Бургьер, Дж. Чинатль, М. Эйкманн, Н. Эскриу, К. Грюна, С. Крамме, Дж. К. Манугерра, С. Мюллер, В. Рикертс, М. Штурмер, С. Вит, Х. Д. Кленк, А. Д. Остерхаус, Х. Шмитц и Х. В. Дорр. 2003. Идентификация нового коронавируса у пациентов с тяжелым острым респираторным синдромом. Н. англ. Дж. Мед. 348 : 1967-1976. [PubMed] [Google Scholar]
21. Эстрада, Дж. К., М. А. Селим и С. Э. Миллер. 2005. ПЭМ ткани из залитых парафином окрашенных гематоксилин-эозином 6-микронных срезов для диагностики вируса (необычный случай паповавируса), с. 964CD. В Р. Прайс, П. Котула, М. Марко, Дж. Х. Скотт, Г. Ф. Вандер Воорт, Э. Манилова, М. М. Л. Нг, К. Смит, Б. Гриффин, П. Смит и С. МакКернан (ред.), Микроскопия и микроанализ, т. 1, с. 11 (С2). Издательство Кембриджского университета, Гонолулу, Гавайи.
МакКернан (ред.), Микроскопия и микроанализ, т. 1, с. 11 (С2). Издательство Кембриджского университета, Гонолулу, Гавайи.
22. Fauquet, C.M., M.A. Mayo, J. Maniloff, U. Desselberger, and L.A. Ball (ред.). 2005. Таксономия вирусов. Классификация и номенклатура вирусов. Восьмой отчет Международного комитета по таксономии вирусов. Elsevier Academic Press, Нью-Йорк, штат Нью-Йорк.
23. Fischer, S.A., M. B. Graham, M.J. Kuehnert, C.N. Kotton, A. Srinivasan, F. M. Marty, J. A. Comer, J. Guarner, C. D. Paddock, D. L. Demeo, W. J. Shieh, B. R. Erickson, U. Bandy, A. ДеМария-младший, Дж. П. Дэвис, Ф. Л. Дельмонико, Б. Павлин, А. Ликос, М. Дж. Винсент, Т. К. Сили, К. С. Голдсмит, Д. Б. Джерниган, П. Э. Роллин, М. М. Паккард, М. Патель, К. Роуленд, Р. Ф. Хелфанд, С. Т. Николь , Дж. А. Фишман, Т. Ксиазек и С. Р. Заки. 2006. Передача вируса лимфоцитарного хориоменингита при трансплантации органов. Н. англ. Дж. Мед. 354 : 2235-2249.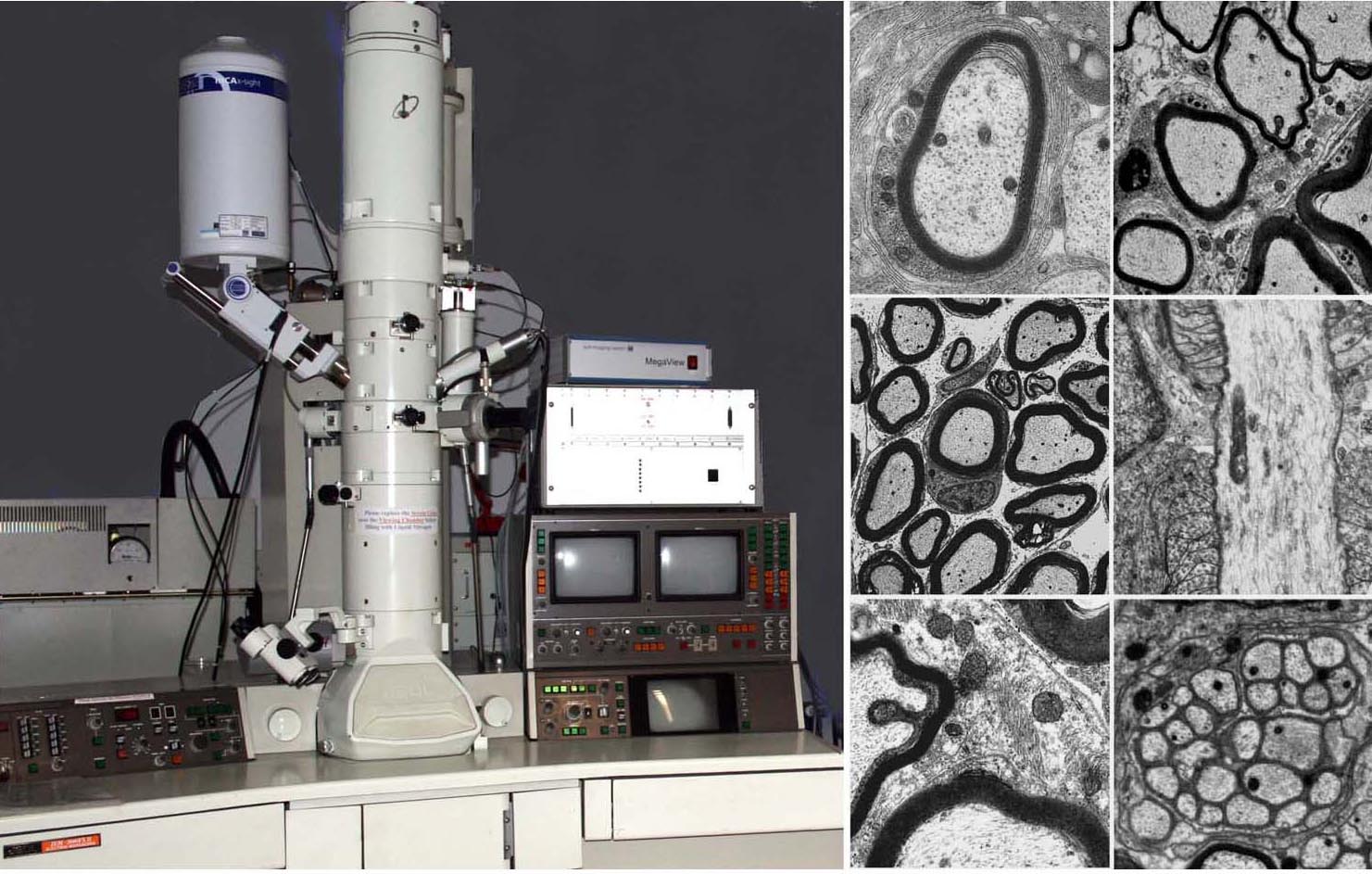 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
24. Фридлендер М., Д. Х. Мур и Х. Копровски. 1955. Изучение под электронным микроскопом взаимоотношений вирус-хозяин в клетках асцитной опухоли Эрлиха. II. Локализация и возможное развитие вируса Anopheles A в эндоплазматическом ретикулуме клеток-хозяев. Дж. Эксп. Мед. 102 : 371-378. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Фридлендер М., Д. Х. Мур, Р. Лав, Р. А. Браун и Х. Копровски. 1955. Изучение под электронным микроскопом взаимоотношений вирус-хозяин в клетках асцитной опухоли Эрлиха. I. Идентификация и структура вируса Anopheles A. Дж. Эксп. Мед. 102 : 362-370. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Гаспер-Смит, Н., Д. М. Кроссман, Дж. Ф. Уайтсайдс, Н. Менсали, Дж. С. Оттингер, С. Г. Плонк, М. А. Муди, Г. Феррари, К. Дж. Вайнхольд, С. Э. Миллер, К. Ф. Райх III, Л. Цинь, С. Г. Селф, Г. М. Шоу, Т. Н. Денни, Л. Э. Джонс, Д. С. Писецкий и Б. Ф. Хейнс. 2008. Индукция плазмы (TRAIL), TNFR-2, лиганда Fas и микрочастиц плазмы после передачи вируса иммунодефицита человека типа 1 (ВИЧ-1): последствия для дизайна вакцины против ВИЧ-1. Дж. Вирол. 82 : 7700-7710. [Бесплатная статья PMC] [PubMed] [Google Scholar]
С. Писецкий и Б. Ф. Хейнс. 2008. Индукция плазмы (TRAIL), TNFR-2, лиганда Fas и микрочастиц плазмы после передачи вируса иммунодефицита человека типа 1 (ВИЧ-1): последствия для дизайна вакцины против ВИЧ-1. Дж. Вирол. 82 : 7700-7710. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Geisbert, T.W., and P.B. Jahrling. 1995. Дифференциация филовирусов с помощью электронной микроскопии. Вирус рез. 39 : 129-150. [PubMed] [Google Scholar]
28. Гейсберт, Т. В., П. Б. Ярлинг, М. А. Хейнс и П. М. Зак. 1992. Ассоциация родственных Эболе частиц вируса Рестон и антигена с поражениями тканей обезьян, завезенных в США. Дж. Комп. Патол. 106 : 137-152. [PubMed] [Google Scholar]
29. Goldsmith, C.S., LH Elliott, CJ Peters, and S.R. Zaki. 1995. Ультраструктурная характеристика вируса Sin Nombre, возбудителя хантавирусного легочного синдрома. Арка Вирол. 140 : 2107-2122. [PubMed] [Google Scholar]
140 : 2107-2122. [PubMed] [Google Scholar]
30. Granzow, H., F. Weiland, D. Fichtner, H. Schutze, A. Karger, E. Mundt, B. Dresenkamp, P. Martin и T.C. Mettenleiter. 2001. Идентификация и ультраструктурная характеристика нового вируса рыб. Дж. Генерал Вирол. 82 : 2849-2859. [PubMed] [Google Scholar]
31. Guarner, J., B.J. Johnson, C.D. Paddock, WJ Shieh, C.S. Goldsmith, M.G. Reynolds, I.K. Damon, R.L. Regnery, and S.R. Zaki. 2004. Передача и патогенез оспы обезьян у луговых собачек. Эмердж. Заразить. Дис. 10 : 426-431. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Гаст, И. Д., Дж. Калдор, Г. Ф. Кросс, М. Во и А. А. Феррис. 1971. Вирусоподобные частицы, связанные с фекальным антигеном больных гепатитом и австралийским антигеном. Ауст. Дж. Эксп. биол. Мед. науч. 49 : 1-9. [PubMed] [Google Scholar]
33. Хандисурья А. , С. Гилч, Д. Винтер, С. Шафти-Керамат, Д. Маурер, Х. М. Шетцль и Р. Кирнбауэр. 2007. Вакцинация частицами, подобными папилломавирусам, содержащими прионовые пептиды, индуцирует аутоантитела к нормальному прионному белку, которые препятствуют выработке патологического прионного белка в инфицированных клетках. ФЕБС Дж. 274 : 1747-1758. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, С. Гилч, Д. Винтер, С. Шафти-Керамат, Д. Маурер, Х. М. Шетцль и Р. Кирнбауэр. 2007. Вакцинация частицами, подобными папилломавирусам, содержащими прионовые пептиды, индуцирует аутоантитела к нормальному прионному белку, которые препятствуют выработке патологического прионного белка в инфицированных клетках. ФЕБС Дж. 274 : 1747-1758. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Haqshenas, G., H.L. Shivaprasad, P.R. Woolcock, D.H. Read, and X.J. Meng. 2001. Генетическая идентификация и характеристика нового вируса, связанного с вирусом гепатита Е человека, от кур с синдромом гепатита-спленомегалия в Соединенных Штатах. Дж. Генерал Вирол. 82 : 2449-2462. [PubMed] [Google Scholar]
35. Hayat, MA, and S.E. Miller. 1990. Негативное окрашивание: применение и методы McGraw-Hill, New York, NY.
36. Haycox, C.L., S. Kim, P. Fleckman, L.T. Smith, M. Piepkorn, J.P. Sundberg, D. N. Howell, and S.E. Miller. 1999. Trichodysplasia spinulosa — недавно описанная фолликулоцентрическая вирусная инфекция у хозяина с ослабленным иммунитетом. Дж. Расследование. Дерматол. Симп. проц. 4 : 268-271. [PubMed] [Google Scholar]
N. Howell, and S.E. Miller. 1999. Trichodysplasia spinulosa — недавно описанная фолликулоцентрическая вирусная инфекция у хозяина с ослабленным иммунитетом. Дж. Расследование. Дерматол. Симп. проц. 4 : 268-271. [PubMed] [Google Scholar]
37. Хейзелтон, П. Р. и Х. Р. Гелдерблом. 2003. Электронная микроскопия для экспресс-диагностики инфекционных агентов в экстренных ситуациях. Эмердж. Заразить. Дис. 9 : 294-303. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Hessling, JJ, SE Miller, and NL Levy. 1980. Прямое сравнение методов обнаружения микоплазмы в культуре тканей. Дж. Иммунол. Методы 38 : 315-324. [PubMed] [Google Scholar]
39. Хауэлл, Д. Н., Д. У. Баттерли и С. Э. Миллер. 2002. Диагностика полиомавирусных инфекций мочевыводящих путей: корреляционный подход. Патол. Дело 7 : 278-283. [Google Scholar]
40. Howell, D. N., S. R. Smith, D. W. Butterly, P. S. Klassen, H. R. Krigman, J. L. Burchette, Jr. и S. E. Miller. 1999. Диагностика и лечение ВК полиомавирусного интерстициального нефрита у реципиентов почечного трансплантата. Трансплантация 68 : 1279-1288. [PubMed] [Google Scholar]
N., S. R. Smith, D. W. Butterly, P. S. Klassen, H. R. Krigman, J. L. Burchette, Jr. и S. E. Miller. 1999. Диагностика и лечение ВК полиомавирусного интерстициального нефрита у реципиентов почечного трансплантата. Трансплантация 68 : 1279-1288. [PubMed] [Google Scholar]
41. Hsiung, G.D., C.K.Y. Fong, and M.L. Landry. 1994. Диагностическая вирусология Сюна: на примере световой и электронной микроскопии. Издательство Йельского университета, Нью-Хейвен, Коннектикут.
42. Hyatt, A.D., and P.W. Selleck. 1996. Ультраструктура морбилливируса лошадей. Вирус рез. 43 : 1-15. [PubMed] [Google Scholar]
43. Hyatt, A.D., M. Williamson, B.E. Coupar, D. Middleton, S.G. Hengstberger, A.R. Gould, P. Selleck, TG Wise, J. Kattenbelt, A.A. Cunningham и J. Ли. 2002 г. Первая идентификация ранавируса у зеленых питонов (Chondropython viridis). Дж. Уайлдл. Дис. 38 : 239-252. [PubMed] [Академия Google]
[PubMed] [Академия Google]
44. Hyatt, A.D., S.R. Zaki, C.S. Goldsmith, T.G. Wise и S.G. Hengstberger. 2001. Ультраструктура вирусов Хендра и Нипах в культивируемых клетках и животных-хозяевах. микробы заражают. 3 : 297-306. [PubMed] [Google Scholar]
45. Джонсон, К. М., Дж. В. Ланге, П. А. Уэбб и Ф. А. Мерфи. 1977. Выделение и частичная характеристика нового вируса, вызывающего острую геморрагическую лихорадку в Заире. Ланцет i : 569-571. [PubMed] [Академия Google]
46. Капикян А. З., Р. Г. Вятт, Р. Долин, Т. С. Торнхилл, А. Р. Калица и Р. М. Чанок. 1972. Визуализация с помощью иммуноэлектронной микроскопии 27-нм частицы, связанной с острым инфекционным небактериальным гастроэнтеритом. Дж. Вирол. 10 : 1075-1081. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Кауше Г., Э. Пфанкух и Х. Руска. 1939. Die Sichtbarmachung von pflanzlichem Virus im Übermikroskop. Натурвиссеншафтен 27 : 292-299. [Google Scholar]
Натурвиссеншафтен 27 : 292-299. [Google Scholar]
48. Клупп, Б.Г., Х. Гранцов, Э. Мундт и Т.С. Меттенлейтер. 2001. Продукт гена UL37 вируса псевдобешенства вовлечен во вторичную оболочку. Дж. Вирол. 75 : 8927-8936. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Кок, Л. П. и М. Э. Бун. 1992. Поваренная книга для микроскопистов. Искусство и наука визуализации, 3-е изд. Coulomb Press Leyden, Лейден, Нидерланды.
50. Ксиазек, Т. Г., Д. Эрдман, К. С. Голдсмит, С. Р. Заки, Т. Перет, С. Эмери, С. Тонг, К. Урбани, Дж. А. Комер, У. Лим, П. Э. Роллин, С. Ф. Доуэлл, А. Э. Линг , CD Humphrey, WJ Shieh, J. Guarner, CD Paddock, P. Rota, B. Fields, J. DeRisi, JY Yang, N. Cox, JM Hughes, JW LeDuc, WJ Bellini и LJ Anderson. 2003. Новый коронавирус, связанный с тяжелым острым респираторным синдромом. Н. англ. Дж. Мед. 348 : 1953-1966. [PubMed] [Google Scholar]
51. Линь Ю., С. Ян, В. Цао, К. Ван, Дж. Фэн, Дж. Дуань и С. Се. 2004 г. Исследование структуры коронавируса SARS с помощью сканирующей электронной микроскопии. Антивир. тер. 9 : 287-289. [PubMed] [Google Scholar]
Линь Ю., С. Ян, В. Цао, К. Ван, Дж. Фэн, Дж. Дуань и С. Се. 2004 г. Исследование структуры коронавируса SARS с помощью сканирующей электронной микроскопии. Антивир. тер. 9 : 287-289. [PubMed] [Google Scholar]
52. Лю Дж., А. Бартесаги, М. Дж. Боргния, Г. Сапиро и С. Субраманиам. 2008. Молекулярная архитектура нативных тримеров gp120 ВИЧ-1. Природа 455 : 109-113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. McKelvey, TA, SC Andrews, SE Miller, CA Ray и DJ Pickup. 2002. Идентификация гена p4c ортопоксвируса, который кодирует структурный белок, направляющий внутриклеточные зрелые вирусные частицы во включения А-типа. Дж. Вирол. 76 : 11216-11225. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Melnick, JL, and C.A. Phillips. 1970. Энтеровирусы: вакцины, эпидемиология, диагностика, классификация. CRC крит. Преподобный Клин. лаборатория науч. 1 : 87-118. [PubMed] [Google Scholar]
лаборатория науч. 1 : 87-118. [PubMed] [Google Scholar]
55. Miller, SE 2003. Биотерроризм и электронно-микроскопическая дифференциация поксвирусов от герпесвирусов: что можно и что нельзя делать. Ультраструктур. Патол. 27 : 133-140. [PubMed] [Google Scholar]
56. Miller, SE 1986. Обнаружение и идентификация вирусов с помощью электронной микроскопии. Дж. Электр. микроск. Тех. 4 : 265-301. [Google Scholar]
57. Miller, S. E. 1995. Диагностика вирусной инфекции методом электронной микроскопии, с. 37-78. В Э. Х. Леннетт, Д. А. Леннетт и Э. Т. Леннетт (ред.), Диагностические процедуры вирусных, риккетсиозных и хламидийных инфекций, 7-е изд. Американская ассоциация общественного здравоохранения, Вашингтон, округ Колумбия.
58. Миллер, С. Э., Р. М. Левенсон, К. Олдридж, С. Хестер, Д. Дж. Кенан и Д. Н. Хауэлл. 1997. Идентификация очаговых вирусных инфекций методом конфокальной микроскопии для последующего ультраструктурного анализа. Ультраструктур. Патол. 21 : 183-193. [PubMed] [Google Scholar]
Ультраструктур. Патол. 21 : 183-193. [PubMed] [Google Scholar]
59. Модис Ю., Б. Л. Трус и С. К. Харрисон. 2002. Атомная модель капсида папилломавируса. EMBO J. 21 : 4754-4762. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Murphy, FA 1975. Таксономия аренавирусов: обзор. Бык. WHO 52 : 389-391. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Нагао С., С. Иидзима, Х. Судзуки, Т. Йокота и С. Шигета. 1982. Вирусоподобные частицы ВК в моче больного с нефротическим синдромом — электронно-микроскопическое наблюдение. Фукусима Дж. Мед. науч. 29 : 45-49. [PubMed] [Google Scholar]
62. Наглер Ф. П. и Г. Рейк. 1948. Использование электронного микроскопа в диагностике натуральной оспы, коровьей оспы и ветряной оспы. Дж. Бактериол. 55 : 45-51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Newcomb, W. W., D. R. Thomsen, FL Homa и JC Brown. 2003. Сборка капсида вируса простого герпеса: идентификация растворимых каркасно-портальных комплексов и их роль в формировании портосодержащих капсидов. Дж. Вирол. 77 : 9862-9871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Newcomb, W. W., D. R. Thomsen, FL Homa и JC Brown. 2003. Сборка капсида вируса простого герпеса: идентификация растворимых каркасно-портальных комплексов и их роль в формировании портосодержащих капсидов. Дж. Вирол. 77 : 9862-9871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Ницше, А., Х. Р. Гелдерблом, К. Эйзендл, Н. Романи и Г. Паули. 2007. Подводные камни при диагностике инфекций, вызванных вирусом оспы человека. Дж. Клин. Вирол. 38 : 165-168. [PubMed] [Google Scholar]
65. Нода Т., Х. Эбихара, Ю. Мурамото, К. Фуджи, А. Такада, Х. Сагара, Дж. Х. Ким, Х. Кида, Х. Фельдманн и Ю. Каваока. 2006. Сборка и почкование Эболавируса. PLoS Патог. 2 : e99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. О’Доннелл, Дж., К. А. Тейлор и М. С. Чепмен. 2009. Аденоассоциированный вирус-2 и его первичная клеточная структура рецептор-крио-ЭМ гепаринового комплекса. Вирусология 385 : 434-443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вирусология 385 : 434-443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Онг, Х. и В. Чандран. 2005. Идентификация желудочно-кишечных вирусов с помощью электронной микроскопии с использованием спектральных характеристик более высокого порядка. Дж. Клин. Вирол. 34 : 195-206. [PubMed] [Google Scholar]
68. Осиро, Л. С. и С. Э. Миллер. 1992. Применение электронной микроскопии для диагностики вирусных инфекций, с. 45-68. В Э. Х. Леннетт (ред.), Лабораторная диагностика вирусных инфекций, 2-е изд. Марсель Деккер, Нью-Йорк, штат Нью-Йорк.
69. Палмер, Э. Л. и М. Л. Мартин. 1982. Атлас вирусов млекопитающих. CRC Press, Бока-Ратон, Флорида.
70. Палмер, Э. Л. и М. Л. Мартин. 1988. Электронная микроскопия в диагностике вирусов. CRC Press, Бока-Ратон, Флорида.
71. Паттин С., Г. ван дер Гроен, Г. Куртель, В. Джейкоб и П. Пиот. 1977. Выделение марбургского вируса от больного геморрагической лихорадкой в Заире. Ланцет i : 573-574. [PubMed] [Google Scholar]
Пиот. 1977. Выделение марбургского вируса от больного геморрагической лихорадкой в Заире. Ланцет i : 573-574. [PubMed] [Google Scholar]
72. Петренко В.А., Сорокулова И.Б. 2004. Обнаружение биологических угроз. Задача направленной молекулярной эволюции. Дж. Микробиол. Методы 58 : 147-168. [PubMed] [Google Scholar]
73. Провенчер С. В. и Р. Х. Фогель. 1988. Трехмерная реконструкция по электронным микрофотографиям неупорядоченных образцов. I. Метод. Ультрамикроскопия 25 : 209-221. [PubMed] [Google Scholar]
74. Рейган Р.Л. и А.Л. Брюкнер. 1952. Морфологические наблюдения с помощью электронной микроскопии штамма Lansing вируса полиомиелита после размножения у швейцарских мышей-альбиносов. Техас Rep. Biol. Мед. 10 : 425-428. [PubMed] [Google Scholar]
75. Рид, К. Д., Дж. В. Мельский, М. Б. Грэм, Р. Л. Регнери, М. Дж. Сотир, М. В. Вегнер, Дж. Дж. Казмерчак, Э. Дж. Стратман, Ю. Ли, Дж. А. Фэрли, Г. Р. Суэйн, В. А. Ол сын, Э. К. Сарджент, С. К. Кель, М. А. Фрайс, Р. Клайн, С. Л. Фолди, Дж. П. Дэвис и И. К. Дэймон. 2004 г. Обнаружение оспы обезьян у людей в Западном полушарии. Н. англ. Дж. Мед. 350 : 342-350. [PubMed] [Google Scholar]
Дж. Сотир, М. В. Вегнер, Дж. Дж. Казмерчак, Э. Дж. Стратман, Ю. Ли, Дж. А. Фэрли, Г. Р. Суэйн, В. А. Ол сын, Э. К. Сарджент, С. К. Кель, М. А. Фрайс, Р. Клайн, С. Л. Фолди, Дж. П. Дэвис и И. К. Дэймон. 2004 г. Обнаружение оспы обезьян у людей в Западном полушарии. Н. англ. Дж. Мед. 350 : 342-350. [PubMed] [Google Scholar]
76. Roingeard, стр. 2008. Обнаружение вирусов с помощью электронной микроскопии: прошлое, настоящее и будущее. биол. Сотовый 100 : 491-501. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Rossmann, M.G., M.C. Morais, PG Leiman, and W. Zhang. 2005. Сочетание рентгеновской кристаллографии и электронной микроскопии. Структура 13 : 355-362. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Ryner, M., JO Strömberg, C. Söderberg-Nauclér и M. Homman-Loudiyi. 2006. Идентификация и классификация капсидов цитомегаловируса человека на текстурированных электронных микрофотографиях с использованием сопоставления деформированных матриц. Вирол. Дж. 3 : 57-69. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вирол. Дж. 3 : 57-69. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Шоепп, Р. Дж., М. Д. Морин, М. Дж. Мартинес, Д. А. Кулеш, Л. Хенсли, Т. В. Гейсберт, Д. Р. Брэди и П. Б. Ярлинг. 2004. Обнаружение и идентификация вируса натуральной оспы в фиксированных тканях человека после длительного архивного хранения. лаборатория расследование 84 : 41-48. [PubMed] [Google Scholar]
80. Шеперд, А. Дж., Н. Дж. Уилсон и К. Т. Смит. 2003. Характеристика эндогенного ретровируса в клеточных линиях грызунов, используемых для производства биологических препаратов. Биопрепараты 31 : 251-260. [PubMed] [Google Scholar]
81. Siegel, JD, E. Rhinehart, M. Jackson, L. Chiarello, et al. 2007 г. Руководство по мерам предосторожности при изоляции: предотвращение передачи инфекционных агентов в медицинских учреждениях. Являюсь. Дж. Заразить. Управление 35 : S65-S164. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Сингх, Х.К., К.А. Андреони, В. Мэдден, К. Тру, Р. Детвайлер, К. Век и В. Никелейт. 2009 г. Наличие мочи по Хауфену точно предсказывает полиомавирусную нефропатию. Варенье. соц. Нефрол. 20 : 416-427. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Singh, HK, V. Madden, YJ Shen, BD Thompson и V. Nickeleit. 2006. Электронная микроскопия мочи с отрицательным окрашиванием для выявления полиомавирусных инфекций. Ультраструктур. Патол. 30 : 329-338. [PubMed] [Google Scholar]
84. Smith, J. A., JF Wellehan, Jr., R. M. Pogranichniy, A. L. Childress, J. A. Landolfi, and K. A. Terio. 2008. Идентификация и выделение нового вируса герпеса в содержавшейся в неволе стае восточно-серых кенгуру (Macropus giganteus). Вет. микробиол. 129 : 236-245. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Sougrat, R., A. Bartesaghi, JD Lifson, AE Bennett, JW Bess, DJ Zabransky и S. Subramaniam. 2007. Электронная томография контакта между Т-клетками и ВИО/ВИЧ-1: значение проникновения вируса. PLoS Патог. 3 : е63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Sougrat, R., A. Bartesaghi, JD Lifson, AE Bennett, JW Bess, DJ Zabransky и S. Subramaniam. 2007. Электронная томография контакта между Т-клетками и ВИО/ВИЧ-1: значение проникновения вируса. PLoS Патог. 3 : е63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Subramaniam, S., A. Bartesaghi, J. Liu, AE Bennett, and R. Sougrat. 2007. Электронная томография вирусов. Курс. мнение Структура биол. 17 : 596-602. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Teunis, PF, CL Moe, P. Liu, SE Miller, L. Lindesmith, R.S. Baric, J. Le Pendu и RL Calderon. 2008. Вирус Норуолк: насколько он заразен? Дж. Мед. Вирол. 80 : 1468-1476. [PubMed] [Google Scholar]
88. Тонг, С.Ю., Р. Хилтон, Э.М. МакМахон, Л. Браун, П. Пантелидис, И.Л. Кристи, И.М. Кидд, М.Ф. Тунгекар и Дж.М. Паттисон. 2004. Мониторинг развития нефропатии, ассоциированной с вирусом BK, у реципиентов почечного трансплантата. Нефрол. Набирать номер. Пересадка. 19 : 2598-2605. [PubMed] [Google Scholar]
Нефрол. Набирать номер. Пересадка. 19 : 2598-2605. [PubMed] [Google Scholar]
89. Touze, A., and P. Coursaget. 1998. Перенос генов in vitro с использованием частиц, подобных вирусу папилломы человека. Нуклеиновые Кислоты Res. 26 : 1317-1323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Touze, A., C. Dupuy, D. Mahe, P.Y. Sizaret и P. Coursaget. 1998. Производство рекомбинантных вирусоподобных частиц из вирусов папилломы человека типов 6 и 11 и изучение серологической реактивности между ВПЧ 6, 11, 16 и 45 с помощью ELISA: последствия для профилактики и обнаружения папилломавируса. ФЭМС микробиол. лат. 160 : 111-118. [PubMed] [Google Scholar]
91. Трус, Б. Л., Р. Б. Роден, Х. Л. Гринстоун, М. Врхел, Дж. Т. Шиллер и Ф. П. Буй. 1997. Новые структурные особенности капсида вируса папилломы крупного рогатого скота, выявленные с помощью трехмерной реконструкции с разрешением 9 Å. Нац. Структура биол. 4 : 413-420. [PubMed] [Google Scholar]
Нац. Структура биол. 4 : 413-420. [PubMed] [Google Scholar]
92. Ван Ройен, К. Э. и Г. Д. Скотт. 1948. Диагностика оспы со специальной ссылкой на электронную микроскопию. Может. J. Общественное здравоохранение 39 : 467-477. [PubMed] [Google Scholar]
93. Vogel, R. H., and S. W. Provencher. 1988. Трехмерная реконструкция по электронным микрофотографиям неупорядоченных образцов. II. Реализация и результаты. Ультрамикроскопия 25 : 223-239. [PubMed] [Google Scholar]
94. фон Шведлер, Великобритания, К. М. Стрей, Дж. Э. Гаррус и У. И. Сандквист. 2003. Функциональные поверхности капсидного белка вируса иммунодефицита человека типа 1. Дж. Вирол. 77 : 5439-5450. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Webster, P. 2007. Обработка и встраивание с помощью микроволнового излучения для просвечивающей электронной микроскопии. Методы Мол. биол. 369 : 47-65. [PubMed] [Google Scholar]
Методы Мол. биол. 369 : 47-65. [PubMed] [Google Scholar]
96. Welch, AB 1971. Очистка, морфология и частичная характеристика реовирусоподобного агента, связанного с диареей новорожденных телят. Может. Дж. Комп. Мед. 35 : 195-202. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Вулкокка П. Р. и Х. Л. Шивапрасад. 2008. Электронно-микроскопическая идентификация вирусов, вызывающих энтерит индюшат, у индеек, выращенных в Калифорнии в 1993-2003 гг. Авиан Дис. 52 : 209-213. [PubMed] [Google Scholar]
98. Xu, P., SE Miller, and WK Joklik. 1993. Генерация ядерных частиц реовируса в клетках, инфицированных гибридными вирусами коровьей оспы, которые экспрессируют сегменты генома L1, L2, L3 и S2. Вирусология 197 : 726-731. [PubMed] [Академия Google]
99. Zaki, S.R., P.W. Greer, L.M.Coffield, C.S.Goldsmith, K.B.Nolte, K. Foucar, R.M.Feddersen, R.E.Zumwalt, G.L.Miller, A.S.Khan, et al. 1995. Хантавирусный легочный синдром. Патогенез возникающего инфекционного заболевания. Являюсь. Дж. Патол. 146 : 552-579. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Foucar, R.M.Feddersen, R.E.Zumwalt, G.L.Miller, A.S.Khan, et al. 1995. Хантавирусный легочный синдром. Патогенез возникающего инфекционного заболевания. Являюсь. Дж. Патол. 146 : 552-579. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Зауча, Г. М., П. Б. Ярлинг, Т. В. Гейсберт, Дж. Р. Сверенген и Л. Хенсли. 2001. Патология экспериментальной аэрозольной вирусной инфекции обезьяньей оспы у яванских макаков (Macaca fascicularis). лаборатория расследование 81 : 1581-1600. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Типы электронных микроскопов — Science Learning Hub
Добавить в коллекцию
Электронные микроскопы были разработаны в 1930-х годах, чтобы мы могли видеть больше ближе к объектам, чем это возможно с помощью светового микроскопа. Ученые правильно предсказали, что микроскоп, использующий электроны вместо видимого света в качестве источника освещения, сможет рассматривать объекты с гораздо более высоким разрешением, чем световой микроскоп. Это связано с тем, что длина волны видимого света ограничивает разрешение световых микроскопов, а длина волны электронов намного меньше.
Это связано с тем, что длина волны видимого света ограничивает разрешение световых микроскопов, а длина волны электронов намного меньше.
Со временем были разработаны специализированные электронные микроскопы, которые могут предоставлять информацию о различных аспектах исследуемого объекта. Это означает, что ученые могут выбрать тот микроскоп, который с наибольшей вероятностью ответит на их вопросы об образце.
Природа науки
Тип данных, которые могут собирать ученые, сильно зависит от доступных им инструментов. По мере того, как микроскопы становились все более сложными, ученые могли рассматривать объекты все более и более подробно. В свою очередь, они смогли ответить на новые вопросы об объектах, которые они изучают.
Что такое электронная микроскопия?
В электронных микроскопах для освещения образца используется пучок электронов, а не видимый свет. Они фокусируют электронный пучок с помощью электромагнитных катушек вместо стеклянных линз (как это делают световые микроскопы), потому что электроны не могут пройти через стекло.
Электронные микроскопы позволяют нам рассматривать объекты гораздо более подробно, чем это возможно с помощью светового микроскопа. Некоторые электронные микроскопы могут обнаруживать объекты размером примерно в одну двадцатую нанометра (10 -9 м) – их можно использовать для визуализации таких маленьких объектов, как вирусы, молекулы или даже отдельные атомы.
В отличие от световых микроскопов, электронные микроскопы нельзя использовать для непосредственного наблюдения за живыми существами из-за специальной подготовки, которую должны пройти образцы перед визуализацией. Вместо этого электронные микроскопы стремятся обеспечить «моментальный снимок» с высоким разрешением момента времени в живой ткани.
Я думаю, что электронный микроскоп внес в науку больший вклад, чем любой другой когда-либо изобретенный научный прибор.
Allan Mitchell, Microscopy Otago
Специализированные виды электронной микроскопии
Для исследования различных аспектов образца было разработано несколько типов электронных микроскопов.
Просвечивающий электронный микроскоп (ПЭМ) был первым разработанным электронным микроскопом. Он работает, направляя пучок электронов на тонкий срез образца и обнаруживая те электроны, которые пробиваются на другую сторону. ПЭМ позволяет нам смотреть в очень высоком разрешении на тонкий срез образца (и, следовательно, аналогичен сложному световому микроскопу). Это делает его особенно полезным для изучения того, как устроены компоненты внутри клетки, такие как органеллы.
Электронная томография — это форма ПЭМ, которая позволяет нам увидеть трехмерное изображение изучаемой клетки или ткани. Видение структур в трех измерениях может значительно облегчить понимание того, как они соотносятся друг с другом. Электронная томография также может давать двумерные изображения с более высоким разрешением, чем обычная ПЭМ.
Сканирующий электронный микроскоп (СЭМ) позволяет увидеть поверхность трехмерных объектов с высоким разрешением.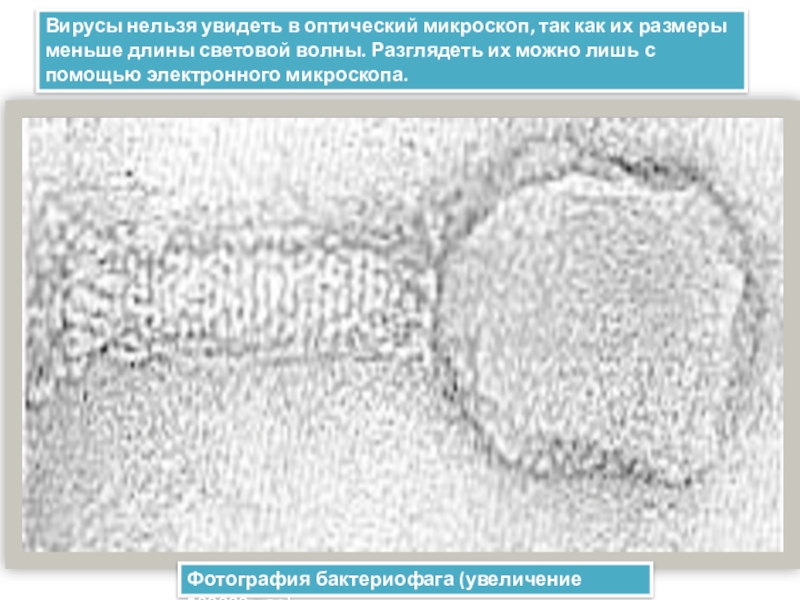 Он работает путем сканирования поверхности объекта сфокусированным пучком электронов и обнаружения электронов, которые отражаются и выбиваются из поверхности образца. При малом увеличении целые объекты (например, насекомые), видимые на РЭМ, могут быть в фокусе одновременно. Вот почему РЭМ так хорош в создании трехмерных изображений вшей, мух, снежинок и так далее.
Он работает путем сканирования поверхности объекта сфокусированным пучком электронов и обнаружения электронов, которые отражаются и выбиваются из поверхности образца. При малом увеличении целые объекты (например, насекомые), видимые на РЭМ, могут быть в фокусе одновременно. Вот почему РЭМ так хорош в создании трехмерных изображений вшей, мух, снежинок и так далее.
CryoSEM — это специализированная форма SEM, которая удобна для изучения объектов, содержащих влагу (например, растений или продуктов питания). В криоСЭМ образцы перед просмотром замораживают в жидком азоте. Это позволяет избежать сложных этапов подготовки, которые выполняются перед обычной СЭМ (в основном для удаления воды из образца). Ученые часто выбирают криоСЭМ, потому что он дает более точное изображение того, как выглядел образец до того, как он был подготовлен для микроскопии.
Дифракция обратного рассеяния электронов (EBSD) используется для детального изучения структуры минералов (например, горных пород). Детекторы EBSD не являются микроскопами сами по себе, а являются дополнением к РЭМ. После того, как электронный луч направлен на породу, EBSD обнаруживает электроны, которые вошли в породу и были рассеяны во всех направлениях. Картина рассеяния может многое рассказать ученым о структуре минерала и ориентации кристаллов внутри него.
Детекторы EBSD не являются микроскопами сами по себе, а являются дополнением к РЭМ. После того, как электронный луч направлен на породу, EBSD обнаруживает электроны, которые вошли в породу и были рассеяны во всех направлениях. Картина рассеяния может многое рассказать ученым о структуре минерала и ориентации кристаллов внутри него.
Идеи для занятий
В разделе Использование теней для создания трехмерных изображений учащиеся моделируют, как ученые интерпретируют данные микроскопа, используя тени объекта под разными углами для создания трехмерного изображения.
В разделе «Какой микроскоп лучше?» учащиеся узнают о различных типах микроскопов и узнают, какой микроскоп лучше всего подходит для конкретного типа образца.
Полезная ссылка
Узнайте больше о Нобелевской премии по физике 1986 года, половина которой была присуждена Эрнсту Руске за разработку первого электронного микроскопа.
Plant & Food Research (PFR) имеет коллекцию изображений, сделанных с помощью сканирующего электронного микроскопа (СЭМ).

 Профессиональный современный световой микроскоп может увеличить изображение в 2 тысячи раз. Электронный микроскоп дает увеличение до 300 тысяч при разрешающей способности 0,5 нм. На таком увеличении уже можно рассмотреть атомы.
Профессиональный современный световой микроскоп может увеличить изображение в 2 тысячи раз. Электронный микроскоп дает увеличение до 300 тысяч при разрешающей способности 0,5 нм. На таком увеличении уже можно рассмотреть атомы.
 Далеко не каждый исследовательский центр может позволить себе ЭМ. Он дорог и при покупке, и в обслуживании.
Далеко не каждый исследовательский центр может позволить себе ЭМ. Он дорог и при покупке, и в обслуживании. С., Скаков Ю. А., Иванов А. Н., Расторгуев Л. Н… Кристаллография, рентгенография и электронная микроскопия. — М.: Металлургия, 1982, 632 с.
С., Скаков Ю. А., Иванов А. Н., Расторгуев Л. Н… Кристаллография, рентгенография и электронная микроскопия. — М.: Металлургия, 1982, 632 с. Micron. Elsevier Ltd. doi.org/10.1016/j.micron.2014.01.009
Micron. Elsevier Ltd. doi.org/10.1016/j.micron.2014.01.009